
以下除杂方法(括号内为少量杂质)中,错误的是( )
A.Fe(OH)3胶体(FeCl3溶液):蒸馏水,渗析
B.KCl(I2)固体:加热,升华
C.NaCl(KNO3):蒸发结晶
D.CO2(SO2):通过饱和NaHCO3溶液、浓硫酸
科目:高中化学 来源: 题型:
向等质量的a、b两份锌粉中,分别加入过量的稀H2SO4,同时向a中加入少量的CuSO4溶液。下图表示产生H2的体积(V)与时间(t)的关系,其中正确的是 ( )
查看答案和解析>>
科目:高中化学 来源: 题型:
强酸与强碱的稀溶液发生中和反应的热效应:H+(aq)+OH-(aq)====H2O(l) ΔH=-57.3 kJ·mol-1。分别向1 L 0.5 mol·L-1的NaOH溶液中加入:①稀醋酸、②浓H2SO4、③稀硝酸,恰好完全反应的热效应分别为ΔH1、ΔH2、ΔH3,它们的关系正确的是( )
A.ΔH1>ΔH2>ΔH3 B.ΔH2<ΔH1<ΔH3
C.ΔH1=ΔH2=ΔH3 D.ΔH1>ΔH3>ΔH2
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子方程式正确的是
A.Na2CO3溶液显碱性:CO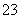 +2H2O===H2CO3+2OH-
+2H2O===H2CO3+2OH-
B.碳酸氢钠溶液中加入足量的烧碱溶液:HCO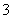 +OH-===CO
+OH-===CO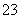 +H2O
+H2O
C.金属钠与水反应:Na+H2O===Na++OH-+H2↑
D.H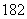 O中投入Na2O2:2H
O中投入Na2O2:2H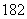 O+2Na2O2===4Na++4OH-+18O2↑
O+2Na2O2===4Na++4OH-+18O2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
下表中,对陈述Ⅰ、Ⅱ的正确性及两者间是否具有因果关系的判断都正确的是
| 选项 | 陈述Ⅰ | 陈述Ⅱ | 判断 |
| A | 碳酸钠溶液可用于治疗胃病 | Na2CO3可与硫酸反应 | Ⅰ对,Ⅱ对,有 |
| B | 将Na2O2加入酚酞试液中,酚酞变红色 | Na2O2与水反应生成氢氧化钠 | Ⅰ对,Ⅱ错,无 |
| C | 金属钠保存在煤油中,以隔绝空气 | 常温下,金属钠在空气中会生成过氧化钠 | Ⅰ对,Ⅱ对,有 |
| D | 过氧化钠可用作航天员的供氧剂 | Na2O2能和CO2、H2O反应生成O2 | Ⅰ对,Ⅱ对,有 |
查看答案和解析>>
科目:高中化学 来源: 题型:
有人用氯化铁、硫酸铜混合溶液进行纸上层析分离实验,实验装置如图所示。
请回答下列问题:
(1)试管中所加展开剂的主要成分是________。
(2)点层析试样是实验的关键操作,进行这一操作时应注意________。
(3)层析操作结束后应进行显色反应,若实验用氨水作为显色试剂,写出本实验中进行显色反应的操作方法:
_____________________________________________。
(4)显色反应后,可观察到________。写出显色反应时所发生反应的离子方程式:_________________________________________________。
(5)若要检验新鲜鸡血中是否含有铁元素,实验操作步骤如下:
①取2 mL新鲜鸡血,将其放入洁净的蒸发皿中,加入2 mL 2 mol·L-1HNO3溶液,加热并不断搅拌。
②将所得溶液蒸干,得到固体粉末。
③取少量固体粉末,将其溶于稀硫酸中,加试剂A,观察现象,判断有无铁元素存在。
操作①的化学原理是________。请列举一种可用于操作③中试剂A的物质________。
查看答案和解析>>
科目:高中化学 来源: 题型:
现有浓度均为0.1 mol/L的下列溶液:
①硫酸、②醋酸、③氢氧化钠、④氯化铵、⑤醋酸铵、⑥硫酸铵、⑦硫酸氢铵、⑧氨水,请回答下列问题:
(1)①、②、③、④四种溶液中由水电离出的H+浓度由大到小的顺序是(填序号)______________________。
(2)④、⑤、⑦、⑧四种溶液中NH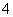 浓度由大到小的顺序是(填序号)________。
浓度由大到小的顺序是(填序号)________。
(3)将③和④等体积混合后,混合液中各离子浓度关系正确的是________。
A.c(Na+)=c(Cl-)>c(OH-)>c(NH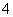 )
)
B.c(Na+)=0.1 mol/L
C.c(Na+)+c(NH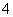 )=c(Cl-)+c(OH-)
)=c(Cl-)+c(OH-)
D.c(H+)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
某化学学习小组为了解硫酸及其盐的某些性质和用途,进行了如下实验探究。
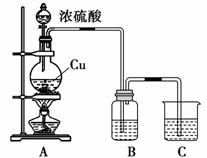
[实验一] 探究浓硫酸的氧化性:
(1)写出烧瓶中反应的化学方程式:____________________________________。
(2)B装置可用于探究SO2的还原性,则B中所用的试剂为:________________(任写一种即可);若B装置是品红溶液,则B中的现象是_______________________________。
[实验二] 检验(NH4)2Fe(SO4)2·6H2O中的金属离子:
(3)请结合化学用语和必要的文字说明如何检验出其中的金属离子(试剂、原理、现象等):______________________________________________________________________。
[实验三] 用KHSO4制取H2O2并测其质量分数:
查阅资料得知:工业上用如下原理制取H2O2:
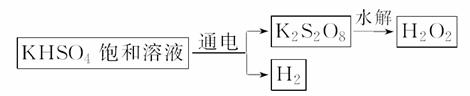
现用此法制取一定浓度的H2O2,并测定H2O2的质量分数。
已知:2MnO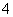 +5H2O2+6H+===2Mn2++8H2O+5O2↑
+5H2O2+6H+===2Mn2++8H2O+5O2↑
①取10.00 mL H2O2溶液(密度为1.00 g·mL-1)置于锥形瓶中加水稀释,并加稀硫酸酸化;
②用0.200 0 mol·L-1KMnO4溶液滴定;
③用同样方法滴定四次,消耗KMnO4溶液的体积分别为:40.00 mL、39.98 mL、42.02 mL、40.02 mL。
(4)用该原理制取H2O2的阳极电极反应式为_______________________________。
(5)进行操作②时,滴入第一滴KMnO4溶液,溶液的紫红色消失很慢,随着滴定的进行,溶液的紫红色消失速率加快,推测其原因可能是_____________________________。
(6)此H2O2溶液中溶质的质量分数为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com