
| A. | 40g SO3气体所占有的体积为11.2L | |
| B. | 1mol固体NaHCO3所含有的阴阳离子总数为3NA | |
| C. | 1mol/L的CH3COOH溶液中,CH3COO-总数小于NA | |
| D. | 常温常压下,32gO2和O3的混合气体含氧原子数为2NA |
分析 A.没有告诉三氧化硫气体的摩尔体积,无法计算40g三氧化硫的体积;
B.1mol固体碳酸氢钠中含有1mol钠离子和1mol碳酸氢根离子;
C.缺少溶液体积,无法计算溶液中醋酸根离子数目;
D.氧气和臭氧都是有氧原子组成,32g混合物中含有32g氧原子,含有2mol氧原子.
解答 解:A.40g三氧化硫的物质的量为:$\frac{40g}{80g/mol}$=0.5mol,题中没有告诉三氧化硫的气体摩尔体积,无法计算0.5mol三氧化硫所占有的体积,故A错误;
B.1mol固体碳酸氢钠中含有1mol钠离子和1mol碳酸氢根离子,总共含有2mol离子,所含有的阴阳离子总数为2NA,故B错误;
C.没有告诉醋酸溶液体积,无法计算溶液中醋酸根离子的数目,故C错误;
D.32gO2和O3的混合气体中含有32g氧元素,含有氧原子的物质的量为:$\frac{32g}{16g/mol}$=2mol,含氧原子数为2NA,故D正确;
故选D.
点评 本题考查阿伏加德罗常数的综合应用,题目难度中等,注意明确标况下气体摩尔体积的使用条件,熟练掌握以物质的量为中心的各化学量与阿伏加德罗常数的关系,C为易错点,注意题中缺少溶液体积.


科目:高中化学 来源: 题型:选择题
| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
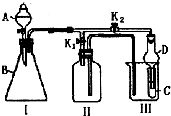 某兴趣小组设计了如图所示的实验装置,既可用于制取气体,又可用于验证物质的性质.
某兴趣小组设计了如图所示的实验装置,既可用于制取气体,又可用于验证物质的性质.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C8H18(l)+$\frac{25}{2}$O2(g)═8CO2(g)+9H2O(g)△H=-48.40 kJ•mol-1 | |
| B. | C8H18(l)+$\frac{25}{2}$O2(g)═8CO2(g)+9H2O(l)△H=-5 517.6 kJ•mol-1 | |
| C. | C8H18(l)+$\frac{25}{2}$O2(g)═8CO2(g)+9H2O(g)△H=+5 517.6 kJ•mol-1 | |
| D. | 2C8H18(l)+25O2(g)═16CO2(g)+18 H2O(l)△H=-5 517.6 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素编号 | 元素性质与原子(或分子)结构 |
| T | 最外层电子数是次外层电子数的3倍 |
| X | 常温下单质为双原子分子,分子中含有3对共用电子对 |
| Y | M层比K层少1个电子 |
| Z | 第三周期元素的简单离子中半径最小 |
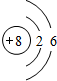 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | A3BC4 | B. | A2(BC4)3 | C. | A2BC3 | D. | A2BC4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
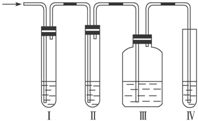 (1)在实验室里制取乙烯常因温度过高而使乙醇和浓H2SO4反应生成少量的SO2,有人设计如图所示实验以确认上述混和气体中有C2H4和SO2. (乙烯的制取装置略)
(1)在实验室里制取乙烯常因温度过高而使乙醇和浓H2SO4反应生成少量的SO2,有人设计如图所示实验以确认上述混和气体中有C2H4和SO2. (乙烯的制取装置略)查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com