
【题目】下列有关离子方程式书写或离子共存说法正确的是
A.在0.1mol/LNa2CO3溶液中:Al3+、NH4+、SO42-、NO3-一定能大量共存
B.常温下,![]() =0.1mol/L的溶液中,下列离子一定能大量共存:K+、Cl-、Fe2+、NO3-
=0.1mol/L的溶液中,下列离子一定能大量共存:K+、Cl-、Fe2+、NO3-
C.清洗锅炉时先用纯碱溶液浸泡的主要原因:CaSO4(s)+CO32-(aq)SO42-(aq)+CaCO3(s)
D.向Al2(SO4)3溶液中加入少量Ba(OH)2溶液:Ba2++SO42-+Al3++3OH-=BaSO4↓+Al(OH)3↓
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】在一定温度下,向冰醋酸中加水稀释,溶液导电能力变化情况图所示,回答下列问题。
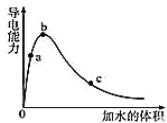
(1)a、b、c三点醋酸电离程度由大到小的顺序为________;a、b、c三点对应的溶液中c(H+)最大的是________。
(2)若实验测得c点处溶液中c(CH3COOH)=0.01 mol·L-1,c(CH3COO-)=0.0001 mol·L-1,则该条件下CH3COOH的电离常数Ka=________________。
(3)在稀释过程中,随着醋酸浓度的降低,下列始终保持增大趋势的量是(_______)。
A.c(H+) B.溶液pH C.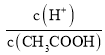 D.CH3COOH分子数
D.CH3COOH分子数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各反应的化学方程式中,属于水解反应的是( )
A.H2O+ H2O![]() H3O++OH-
H3O++OH-
B.CO2+H2O![]() H2CO3
H2CO3
C.HCO3-+OH-![]() H2O+CO32-
H2O+CO32-
D.CO32-+ H2O![]() HCO3- +OH-
HCO3- +OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2.0mol PCl3和1.0mol Cl2充入体积不变的密闭容器中,在一定条件下发生下述反应: PCl3(g)+Cl2(g)![]() PCl5(g)达平衡时,PCl5为0.40mol,如果此时再移走1.0mol PCl3和0.50mol Cl2,在相同温度下再达平衡时PCl5的物质的量是( )
PCl5(g)达平衡时,PCl5为0.40mol,如果此时再移走1.0mol PCl3和0.50mol Cl2,在相同温度下再达平衡时PCl5的物质的量是( )
A.0.40molB.0.20mol
C.小于0.20molD.大于0.20mol,小于0.40mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上有一种用CO2生产甲醇燃料的方法:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH=-49.0 kJ/mol。某实验中将6 mol CO2和8 mol H2充入2L的密闭容器中,测得H2的物质的量随时间变化如图曲线 (甲)所示。请完成下列问题:
CH3OH(g)+H2O(g) ΔH=-49.0 kJ/mol。某实验中将6 mol CO2和8 mol H2充入2L的密闭容器中,测得H2的物质的量随时间变化如图曲线 (甲)所示。请完成下列问题:
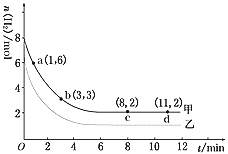
(1)a点正反应速率________逆反应速率(填“>”、“<”或“=”)。
(2)若仅改变某一实验条件再进行一次实验,测得H2的物质的量随时间变化如图中虚线(乙)所示,曲线(乙)对应改变的实验条件可以是________(填序号)。
a.加催化剂 b.增大压强 c.升高温度 d.增大H2浓度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】画出CH3﹣C≡C﹣CH=CH2分子的立体结构式____________,分析该分子式中有_____个碳原子共线,_____碳原子共面,最少有_____个原子共面,最多有_____原子共面.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用电源串联电解分别装在两烧杯里的600mL 0.3 mol/L AgNO3 和300 mL 0.5 mol/L的NaCl溶液,以铂作电极,电解一段时间(两烧杯里溶质均有剩余)取出电极,将两杯溶液混合,对混合液的pH判断正确的是 ( )
A.小于7B.大于7C.等于7D.大于或等于7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮元素的化合物应用十分广泛。请回答:
(1)火箭燃料液态偏二甲肼(C2H8N2)是用液态N2O4作氧化剂,二者反应放出大量的热,生成无毒、无污染的气体和水。已知室温下,1 g燃料完全燃烧释放出的能量为42.5 kJ,则该反应的热化学方程式为_________。
(2)298 K时,在2 L固定体积的密闭容器中,发生可逆反应:
2NO2(g)![]() N2O4(g) ΔH=-a kJ·mol-1(a>0)
N2O4(g) ΔH=-a kJ·mol-1(a>0)
N2O4的物质的量浓度随时间变化如图。达平衡时,N2O4的浓度为NO2的2倍,回答下列问题:
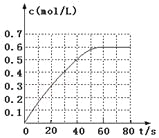
① 298k时,该反应的平衡常数为_____L·mol-1(精确到0.01)。
②下列情况不是处于平衡状态的是______:
A.混合气体的密度保持不变;
B.混合气体的颜色不再变化;
C.气压恒定时。
③若反应在398K进行,某时刻测得n(NO2)="0.6" mol,n(N2O4)="1.2" mol,则此时V(正)___V(逆)(填“>”、“<”或“=”)。
(3)NH4HSO4在分析试剂、医药、电子工业中用途广泛。
现向100 mL 0.1 mol·L-1NH4HSO4溶液中滴加0.1 mol·L-1NaOH溶液,得到的溶液pH与NaOH溶液体积的关系曲线如图所示。试分析图中a、b、c、d、e五个点,
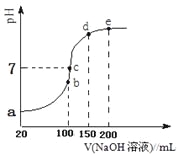
①b点时,溶液中发生水解反应的离子是______;
②在c点,溶液中各离子浓度由大到小的排列顺序___________。
③d、e点对应溶液中,水电离程度大小关系是d______e(填“>”、“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了检验淀粉水解的产物,设计如下实验方案:
![]()
请回答下列问题:
(1)试剂1为20%的H2SO4溶液,其作用是_________;
(2)试剂2为_________NaOH溶液,其作用是_________,使检验水解产物的实验得以顺利进行;发生反应的离子方程式为:_________;
(3)反应①的化学方程式为_________;
(4)为检验淀粉液是否已完全水解,取少量水解液于试管中,加入碘水,则证明淀粉未完全水解的现象是_________;
(5)如果实验过程中没有加入试剂2而直接加入试剂3,能否实现实验目的_________(填”能”或”否”)否,若不能,其原因是_________硫酸能溶解Cu(OH)2而使实验失败,最简单的改正措施是_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com