
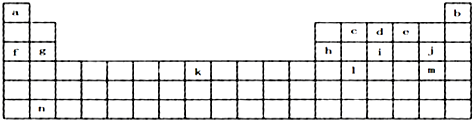
 ,元素c在周期表的位置第二周期IVA族
,元素c在周期表的位置第二周期IVA族分析 由元素周期表中位置,可知a是H,b是He,c是C,d是N,e是O,f是Na,g是Mg,h是Al,i是P,j是Cl,k是Fe,l是Ge,m是Br,n为Ba.
(1)上表所列元素中,原子最外层只有2个电子的短周期元素为Ⅱ族元素与He;元素j的最高价氧化物的水化物为高氯酸,元素i最高价氧化物为五氧化二磷;
(2)NH3存在分子间氢键,沸点比较高;
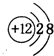
(3)g的离子为Mg2+,离子核外电子数为10;元素c在周期表的位置:第二周期IVA族;
(4)第三周期主族元素原子序数之差等于族序数之差;主族元素最低负化合价=族序数-8,进而实现氢化物化学式;
(5)m为Br,处于第四周期VIIA族.
解答 解:由元素周期表中位置,可知a是H,b是He,c是C,d是N,e是O,f是Na,g是Mg,h是Al,i是P,j是Cl,k是Fe,l是Ge,m是Br,n为Ba.
(1)上表所列元素中,原子最外层只有2个电子的短周期元素是Mg、He,元素j的最高价氧化物的水化物为HClO4,元素i最高价氧化物为P2O5,
故答案为:Mg、He;HClO4;P2O5;
(2)NH3存在分子间氢键,沸点比较高,
故答案为:NH3存在分子间氢键;
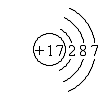
(3)g的离子为Mg2+,离子核外电子数为10,离子结构示意图为 ;元素c在周期表的位置:第二周期IVA族,
;元素c在周期表的位置:第二周期IVA族,
故答案为: ;第二周期IVA族;
;第二周期IVA族;
(4)已知与f在同一周期的元素R位于第p主族,则R的原子序数为10+p,R能形成气态氢化物,其氢化物的化学式为H8-pR,
故答案为:10+p;H8-pR;
(5)m为Br,处于第四周期VIIA族,原子核外电子排布式为:[Ar]3d104s24p5,
故答案为:[Ar]3d104s24p5.
点评 本题考查元素周期表与元素周期律,熟练掌握元素周期表的结构,注意氢键对物质性质的影响,理解掌握同主族原子序数关系.


科目:高中化学 来源: 题型:选择题
| A. | 晶体熔点由低到高:CF4<CCl4<CBr4<CI4 | |
| B. | 熔点由高到低:Na>Mg>Al | |
| C. | 硬度由大到小:金刚石>碳化硅>晶体硅 | |
| D. | 四种气态氢化物按稳定性:SiH4<CH4<H2O<HF |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验 | 现象 | 离子方程式 | |
| A |  | 在空气中放置一段时间后,溶液呈蓝色 | 4H++4I-+O2═2I2+2H2O |
| B | 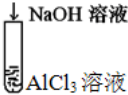 | 溶液由先浑浊后澄清 | Al3++3OH-═Al(OH)3↓ Al(OH)3+OH-═AlO2-+2H2O |
| C | 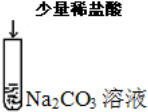 | 溶液中无气泡产生 | CO22-+H+=HCO3-+H2O |
| D |  | 有白色沉淀生成,溶液由红色变为无色 | Ba2++OH-+H++SO42-═BaSO4↓+H2O |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 新戊烷 C(CH3)4 | B. | 3-乙基-1-丁烯 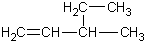 | ||
| C. | 2-甲基-2,4-己二烯 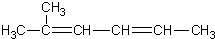 | D. | 2,2,3-三甲基戊烷 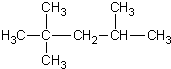 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 有A、B、C、D四种元素,其中A元素和B元素的原子都有1个未成对电子,A+比B-少一个电子层,B原子得一个电子后3p轨道全满;C原子的p轨道中有3个未成对电子,其气态氢化物在水中的溶解度在同族元素所形成的氢化物中最大;D的最高化合价和最低化合价的代数和为4,其最高价氧化物中含D的质量分数为40%,且其核内质子数等于中子数.R是由A、D两元素形成的离子化合物,其中A与D离子数之比为2:1.请回答下列问题:
有A、B、C、D四种元素,其中A元素和B元素的原子都有1个未成对电子,A+比B-少一个电子层,B原子得一个电子后3p轨道全满;C原子的p轨道中有3个未成对电子,其气态氢化物在水中的溶解度在同族元素所形成的氢化物中最大;D的最高化合价和最低化合价的代数和为4,其最高价氧化物中含D的质量分数为40%,且其核内质子数等于中子数.R是由A、D两元素形成的离子化合物,其中A与D离子数之比为2:1.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | E(3s)>E(3p)>E(3d) | B. | E(3s)>E(2s)>E(2 p) | C. | E(4f)>E(3d)>E(4s) | D. | E(5s)>E(4s)>E(4f) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在基态多电子原子中,p轨道电子能量不一定高于s轨道电子能量 | |
| B. | 核外电子排布由1s22s22p63s1→1s22s22p6 的变化需要吸收能量 | |
| C. | 某元素基态原子的电子排布图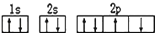 | |
| D. | Ca2+离子基态电子排布式为1s22s22p63s23p6 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
. .
.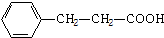 .
. 单体.
单体.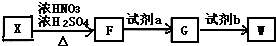
 ,试剂a为酸性KMnO4 溶液.
,试剂a为酸性KMnO4 溶液.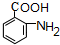 $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$ +(n-1)H2O.
+(n-1)H2O.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com