
有关物质的转化关系如下图所示(部分物质和条件已略去)。A、C是常见的金属单质,B是黑色有磁性的氧化物,X是黄绿色气体,Y是常见的酸,Z是常见的碱,其焰色反应显黄色。反应①需在高温下进行。

请回答下列问题:
(1) Z的电子式为________。
(2) G的化学式为________。
(3) 写出①的化学方程式:________。
(4) 写出I转化为J的离子方程式:________。
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2017届河南省濮阳市高三第一次模拟考试理综化学试卷(解析版) 题型:简答题
MnO2是常见的氧化剂、催化剂和活性电极材料。
(1)工业上,以惰性材料为电极,电解MnSO4溶液(含少量稀硫酸)制备MnO2。写出阳极的电极反应式:___________。
(2)已知如下热化学方程式(K代表平衡常数):
①MnCO3(s) MnO(s)+CO2(g) △H1 K1
MnO(s)+CO2(g) △H1 K1
②2MnO(s)+O2(g) 2MnO2(s) △H2 K2
2MnO2(s) △H2 K2
③2MnCO3(s)+O2(g) 2MnO2(s)+2CO2(g) △H3 K3
2MnO2(s)+2CO2(g) △H3 K3
△H3=______(用△H1、△H2表示) K3=_______(用K1、K2表示)。
(3)反应②在低温条件下能自发进行,则△H2______0(填“>”“<”或“=”)。
(4)在密闭容器中投入足量的MnCO3,—定条件下发生反应:MnCO3(s) MnO(s)+CO2(g)
MnO(s)+CO2(g)
△H>0。在一定温度下,达到平衡状态时p(CO2)=2a MPa。

① 温度、压强对MnCO3分解率的影响如图所示:比较:L1____L2(填“>”“<”或“=”)。
② 保持温度不变,将容器体积扩大至原来的2倍,则p(CO2)的变化范围是______。
③ 保持温度不变,将容器体积压缩至原来的一半,达到新平衡时下列物理量-定不变的是__(填代号)。
A.平衡常数K B.c(CO2) C.n(CO2) D.m(MnCO3)
(5)—定温度下,在容积为2L的恒容密闭容器中加人足量的MnCO3(s)和5molO2,发生反应:2MnCO(s)+O2(g) 2MnO2(s)+2CO2(g),CO2以平均速率0.1mol• L-1·min-1经过10min达到平衡状态。该条件下该反应的平衡常数K为_______。
2MnO2(s)+2CO2(g),CO2以平均速率0.1mol• L-1·min-1经过10min达到平衡状态。该条件下该反应的平衡常数K为_______。
查看答案和解析>>
科目:高中化学 来源:2017届海南省琼海市高三下学期第一次月考化学试卷(解析版) 题型:填空题
元素铬(Cr)在溶液中主要以Cr3+(蓝紫色)、Cr(OH)4?(绿色)、Cr2O72?(橙红色)、CrO42?(黄色)等形式存在,Cr(OH)3为难溶于水的灰蓝色固体,回答下列问题:
(1)Cr3+ 与 Al3+ 的化学性质相似,在Cr2(SO4)3 溶液中逐滴加入NaOH溶液直至过量,可观察到的现象是_________。
(2)CrO42? 和 Cr2O72? 在溶液中可相互转化。室温下,初始浓度为1. 0 mol·L?1的Na2CrO4 溶液中c(Cr2O72?) 随c(H+) 的变化如图所示。

①用离子方程式表示Na2CrO4溶液中的转化反应____________。
②由图可知,溶液酸性减小,CrO42? 的平衡转化率__________(填“增大”“减小”或“不变”)。根据A点数据,计算出该转化反应的逆反应的平衡常数为__________。
③升高温度,溶液中CrO42?的平衡转化率减小,则该反应的ΔH____0(填“大于”“小于”或“等于”)。
(3)+6价铬的化合物毒性较大,常用NaHSO3将废液中的 Cr2O72? 还原成 Cr3+,反应的离子方程式为______________。
查看答案和解析>>
科目:高中化学 来源:2017届四川外语学院重庆第二外国语学校高三下学期第二次检测理科综合化学试卷(解析版) 题型:填空题
芦笋中的天冬酰胺(结构如图)和微量元素硒、铬、锰等,具有提高身体免疫力的功效。
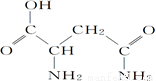
(1)天冬酰胺所含元素中,________(填元素名称,下同)元素基态原子核外未成对电子数最多,第一电离能最大的是________。
(2)天冬酰胺中碳原子的杂化轨道类型为________,分子中σ键和π键数目之比为________。
(3)O、S、Se为同主族元素,H2O、H2S和H2Se的参数对比见表。
化学式 | 键长/nm | 键角 |
H2O | 0.99 | 104.5° |
H2S | 1.34 | 92.3° |
H2Se | 1.47 | 91.0° |
H2S的键角大于H2Se的原因可能为________________________________________。
H2O、H2S、H2Se沸点由高到低的顺序为________________,酸性由强到弱的顺序为________________。
(4)写出铬的基态原子电子排布式:________________________________________。
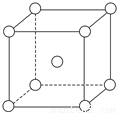
(5)铬为体心立方晶体,晶胞结构如图,则该晶胞中含有______个铬原子。若铬的密度为ρg·cm-3,相对原子质量为M,NA表示阿伏加德罗常数的值,则铬原子的半径为______cm。
查看答案和解析>>
科目:高中化学 来源:2017届四川外语学院重庆第二外国语学校高三下学期第二次检测理科综合化学试卷(解析版) 题型:选择题
下列有关实验原理或操作正确的是( )
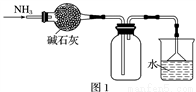
A. 图1所示的装置可用于干燥、收集并吸收多余的氨气
B. 用广泛pH试纸测得0.1mol·L-1NaClO溶液的pH值约为12
C. 用蒸发溶剂的方法将10%的Ca(HCO3)2溶液变为20%的Ca(HCO3)2溶液
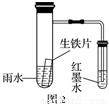
D. 用图2的装置可以验证生铁片在该雨水中是否会发生吸氧腐蚀
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江苏省无锡市高二学业水平模拟(十四)化学试卷(解析版) 题型:选择题
下列有机反应属于加成反应的是( )
A. 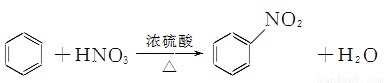
B. 2CH3CH2OH +2Na―→CH3CH2ONa+H2↑
C. CH2==CH2+Br2―→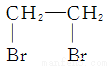
D. 2CH3CH2OH +O2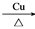 2CH3CHO+2H2O
2CH3CHO+2H2O
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江苏省无锡市高二学业水平模拟(十四)化学试卷(解析版) 题型:选择题
下列各组物质互为同分异构体的是
A. O2和O3 B. CH3CH2CH2CH3和CH(CH3)3
C. 12C和13C D. CH4和CH3CH3
查看答案和解析>>
科目:高中化学 来源:2016届辽宁省葫芦岛市高三上学期第二次周考理综化学试卷(解析版) 题型:填空题
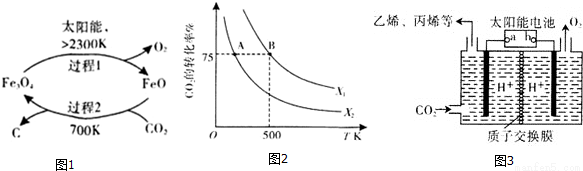
二氧化碳的回收利用是环保领域研究的热点课题。
(1)在太阳能的作用下,以CO2为原料制取炭黑的流程如图1所示,其总反应的化学方程式为_________。
(2)CO2经过催化氢化合成低碳烯烃.其合成乙烯的反应为2CO2(g)+6H2(g) CH2=CH2(g)+4H2O(g)△H,几种物质的能量(在标准状况下,规定单质的能量为0,测得其他物质在生成时所放出或吸收的热量)如下表所示:
CH2=CH2(g)+4H2O(g)△H,几种物质的能量(在标准状况下,规定单质的能量为0,测得其他物质在生成时所放出或吸收的热量)如下表所示:
物质 | H2(g) | CO2(g) | CH2=CH2(g) | H2O(g) |
能量/kJ•mol-1 | 0 | -394 | 52 | -242 |
则△H=_________。
(3)在2L恒容密闭容器中充入2molCO2和nmol H2,在一定条件下发生(2)中的反应,CO2的转化率与温度、投料比[X= 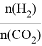 ]的关系如图2所示。
]的关系如图2所示。
①X1_________X2(填“>”、“<”或“=”,下同),平衡常数KA_________KB.
②若B点的投料比为3,且从反应开始到B点需要10min,则v(H2)=_________。
(4)以稀硫酸为电解质溶液,利用太阳能将CO2转化为低碳烯烃,工作原理图如图3。
①b电极的名称是_________;
②产生丙烯的电极反应式为_______________。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖北省枣阳市高一下学期第一次质量检测化学试卷(解析版) 题型:选择题
以下对化学变化的认识不正确的是
A. 会引起化学键的变化 B. 会产生新的物质
C. 必然引起物质状态的变化 D. 必然伴随着能量的变化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com