
在一定温度下将100mLN2,H2混合气充入密闭恒压容器内,发生反应达到平衡时维持温度不变,测得混合气的密度是反应前密度的1.25倍,平均分子量为15.5。求平衡时N2的转化率;N2,H2两种气体开始时各为多少毫升?
平衡时N2的转化率25%;N2,H2两种气体开始的体积分别为40mL和60mL。
∵同T同P下有(ρ1/ρ2)=(m1/m2)
∴有(1/1.25)=(m1/15.5)?解得m1=12.4

(V1/V2)=(n1/n2)
即:?VN2∶VH2=10.4∶15.6
∴?VN2=10.4/(10.4+15.6)×100mL=40mL
??VH2=100mL-40mL=60mL
设N2转化的体积为x,则有:
?????N2? + ?3H2![]() 2NH3
2NH3
起始体积 40 60 0
转化体积 x 3x 2x
平衡体积 40-x 60-3x 2x
?V总=40-x+60-3x+2x=100-2x
∴有:
15.5=((40-x)×28+(60-3x)×2+2x×17)/(100-2x)
解得?x=10mL
∴N2的转化率为:
N2%=(10/40)×100%=25%


科目:高中化学 来源: 题型:
| 催化剂 |
| 催化剂 |
| ||
| △ |
| ||
| △ |
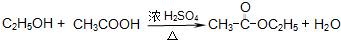
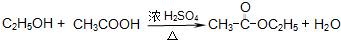
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 时间/s | 0 | 500 | 100 0 | 150 0 |
| c(N2O5)/mol?L-1 | 5.00 | 3.52 | 2.50 | 2.50 |
| A、T1温度下的平衡常数为K1,T2温度下的平衡常数为K2,若T1>T2,则K1<K2 | ||
| B、500s内N2O5分解速率为2.96×10-3mol?L-1?s-1 | ||
| C、T1温度下的平衡常数为K1=125,平衡时N2O5的转化率为50% | ||
D、达平衡后其他条件不变,将容器的体积压缩到原来的
|
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com