
分析 (1)①CO32-水解而使其水溶液呈碱性,写出CO32-第一步水解的离子方程式为:CO32-+H2O?HCO3-+OH-,水解常数Kh=$\frac{c(HC{O}_{3}^{-})•c(O{H}^{-})}{c(C{O}_{3}^{2-}\\;)}$,当溶c(HCO3-):c(CO32-)=20:1时,根据水解常数计算c(OH-),由根据水的离子积Kw计算c(H+),根据pH=-lgc(H+)计算;
②Al2(SO4)3与NaHCO3混合时能相互促进水解生成氢氧化铝沉淀、二氧化碳气体;
(2)溶液A中NaNO3、NaNO2的浓度均为0.1mol/L,HNO2、CH3COOH均为弱酸,由电离常数可知CH3COOH酸性小于HNO2的酸性,溶液中醋酸根离子水解程度大于亚硝酸根离子水解程度,溶液B碱性大于A溶液;
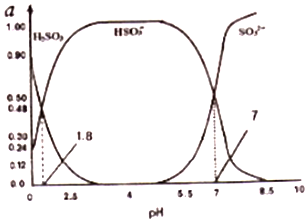
(3)①A、由电荷守恒可知,c(H+)+c(Na+)═2c(SO32-)+c(HSO3-)+c(OH-),中性溶液则c(H+)═c(OH-),则c(Na+)═2c(SO32-)+c(HSO3-),所以c(Na+)>2c(SO32-),而图可知pH=7时,c(SO32-)=c(HSO3-),则c(Na+)>2c(SO32-)>c(HSO3-),故A 正确;
B、由电荷守恒可知,c(H+)+c(Na+)═2c(SO32-)+c(HSO3-)+c(OH-),中性溶液则c(H+)═c(OH-),则c(Na+)═2c(SO32-)+c(HSO3-),c(SO32-)≠c(H2SO3),故B错误;
C、pH=7时,c(H+)=c(OH-);
D、HSO3-电离程度大于水解程度导致溶液呈酸性,因为亚硫酸氢根离子既能电离又能水解,所以溶液中存在H2SO3、SO32-,在NaHSO3溶液中存在电荷守恒和物料守恒,根据电荷守恒和物料守恒判断;
②HSO3-?SO32-+H+,由图中数据,pH=7时,c(HSO3- )=c(SO32- ),由Ka的表达式可知,H2SO3的第二级电离平衡常数K2≈c(H+)=10-7,由此分析解答.
解答 解:(1)①CO32-水解而使其水溶液呈碱性,写出CO32-第一步水解的离子方程式为:CO32-+H2O?HCO3-+OH-,水解常数Kh=$\frac{c(HC{O}_{3}^{-})•c(O{H}^{-})}{c(C{O}_{3}^{2-}\\;)}$=2×10-4,当溶液中c(HCO3-):c(CO32-)=20:1时,c(OH-)=10-5mol/L,由水的离子积Kw可知,c(H+)=10-9mol/L,所以pH=-lg10-9=9,
故答案为:CO32-+H2O?HCO3-+OH-;9;
②Al2(SO4)3与NaHCO3混合时能相互促进水解生成氢氧化铝沉淀、二氧化碳气体,离子方程式为Al3++3HCO3-═Al(OH)3↓+3CO2↑,
故答案为:3HCO3-+Al3+=Al(OH)3↓+3CO2↑;
(2)0.2mol NaOH的水溶液与0.2mol NO2恰好完全反应得1L溶液A,由2NO2+2NaOH═NaNO3+NaNO2+H2O,得到溶液A中NaNO3物质的量浓度为0.1mol/L,NaNO2物质的量浓度为0.1mol/L,溶液B为0.1mol•L-1的CH3COONa溶液;
HNO2的电离常数Ka=7.1×10-4mol•L-1,CH3COOH的电离常数Ka=1.7×10-5mol•L-1,说明CH3COOH酸性小于HNO2的酸性,溶液中醋酸根离子水解程度大于亚硝酸根离子水解程度,溶液B碱性大于A溶液,两溶液中c(NO3-)、c(NO2-)和c(CH3COO-)由大到小的顺序为c(NO3-)>c(NO2-)>c(CH3COO-),
A.向溶液A中加适量NaOH,增大碱性,可以调节溶液pH相等,故正确;
B.溶液B碱性大于A溶液,向溶液A中加适量水,稀释溶液,碱性减弱,不能调节溶液pH相等,故错误;
C.溶液B碱性大于A溶液,向溶液B中加适量NaOH,溶液pH更大,故错误;
D.向溶液B中加适量水,稀释溶液碱性减弱,可以调节溶液pH相等,故正确;
故答案为:c(NO3-)>c(NO2-)>c(CH3COO-);AD;
(3)①A、由电荷守恒可知,c(H+)+c(Na+)═2c(SO32-)+c(HSO3-)+c(OH-),中性溶液则c(H+)═c(OH-),则c(Na+)═2c(SO32-)+c(HSO3-),所以c(Na+)>2c(SO32-),而图可知pH=7时,c(SO32-)=c(HSO3-),则c(Na+)>2c(SO32-)>c(HSO3-),故A 正确;
B、由电荷守恒可知,c(H+)+c(Na+)═2c(SO32-)+c(HSO3-)+c(OH-),中性溶液则c(H+)═c(OH-),则c(Na+)═2c(SO32-)+c(HSO3-),c(SO32-)≠c(H2SO3),故B错误;
C、pH=7时,c(H+)=c(OH-),故C错误;
D、SO32-+H2O?HSO3-+OH-,HSO3-?H++SO32-,亚硫酸两步水解,则离子浓度为c(Na+)>c(HSO3-)=c(SO32-)>c(H+)=c(OH-),故D错误;故答案为:A;
②亚硫酸的第一步电离方程式为:H2SO3?H++HSO3-,根据图象可知,pH=0时,亚硫酸浓度为0.9mol/L,亚硫酸氢根离子浓度为0.24mol/L,此时氢离子浓度为1mol/L,则Ka1=$\frac{0.24×1}{0.9}$≈0.27,故答案为:0.27.
点评 本题考查了离子浓度大小比较,题目难度中等,明确图象中曲线变化的含义为解答关键,注意掌握电荷守恒、物料守恒及质子守恒在判断离子浓度大小中的应用方法.


 新思维假期作业寒假吉林大学出版社系列答案
新思维假期作业寒假吉林大学出版社系列答案科目:高中化学 来源: 题型:解答题
| 溶液中被沉淀的离子 | Fe3+ | Fe2+ | Cu2+ |
| 完全生成氢氧化物的沉淀时,溶液的pH | ≥3.7 | ≥6.4 | ≥4.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
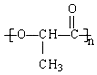 一次性使用的聚苯乙烯材料带来的“白色污染”就是一种较为严重的污染现象,最近研制的一种新型材料 能代替聚苯乙烯.它是由乳酸聚合而成的.这种材料可以在乳酸菌作用下完全降解.下列关于聚乳酸的说法正确的是( )
一次性使用的聚苯乙烯材料带来的“白色污染”就是一种较为严重的污染现象,最近研制的一种新型材料 能代替聚苯乙烯.它是由乳酸聚合而成的.这种材料可以在乳酸菌作用下完全降解.下列关于聚乳酸的说法正确的是( )| A. | 聚乳酸是一种纯净物 | B. | 聚乳酸的聚合方式与聚苯乙烯相似 | ||
| C. | 聚乳酸的单体为CH3CH(OH)COOH | D. | 聚乳酸的链节为n |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
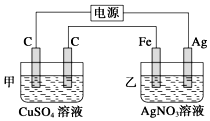 观察如图所示装置,在通电一段时间后,铁电极的质量增加了5.4g.
观察如图所示装置,在通电一段时间后,铁电极的质量增加了5.4g.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
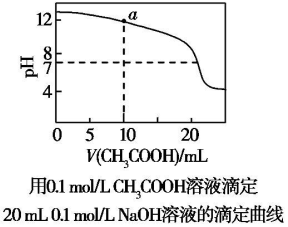
| A. | pH相等的CH3COONa、NaOH和Na2CO3三种溶液:c(CH3COONa)<c(Na2CO3)<c(NaOH) | |
| B. | H2A为弱酸,则0.1 mol.L-1NaHA溶液中:c(Na+)=2c(A2-)+c(HA-)+c(H2A) | |
| C. | 图中pH=7时:c(Na+)>c(CH3COO-)>c(OH-)=c(H+) | |
| D. | 上图中a点溶液:c(OH-)=c(H+)+c(CH3COO-)+2c(CH3COOH) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③④ | B. | ②⑤⑦ | C. | ②④⑦ | D. | ③④⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硝酸银溶液与铜:Cu+Ag+=Cu2++Ag | |
| B. | 氧化铜与盐酸反应:O2-+2H+=H2O | |
| C. | 硫酸氢钠与氢氧化钠溶液混合:OH-+H+=H2O | |
| D. | 向澄清石灰水中加入盐酸:2H++Ca(OH)2=Ca2++2H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com