
科目:高中化学 来源: 题型:
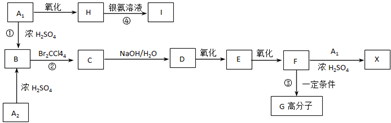
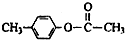 、
、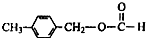 外,其余的结构简式:
外,其余的结构简式:查看答案和解析>>
科目:高中化学 来源: 题型:
| 催化剂 |
| △ |
| A、0.24 mol?L-1 |
| B、0.28 mol?L-1 |
| C、0.32 mol?L-1 |
| D、0.26 mol?L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、只有AgCl沉淀生成 |
| B、只有AgI沉淀生成 |
| C、生成等物质的量的AgCl和AgI沉淀 |
| D、两种沉淀都有,但以AgI为主 |
查看答案和解析>>
科目:高中化学 来源: 题型:
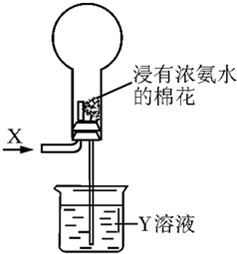
| A、若X为HCl,则烧瓶内可产生白雾 |
| B、选择适当的X和Y溶液可产生有色喷泉 |
| C、若烧瓶内产生喷泉,则Y溶液一定呈酸性 |
| D、若通入气体为Cl2,则烧瓶内一定无喷泉产生 |
查看答案和解析>>
科目:高中化学 来源: 题型:
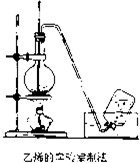 实验室制取乙烯的装置如图所示,请根据图示回答下列问题:
实验室制取乙烯的装置如图所示,请根据图示回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、热稳定性:Na2CO3>NaHCO3 |
| B、相同浓度溶液的碱性:Na2CO3>NaHCO3 |
| C、相同温度下在水中的溶解度:Na2CO3>NaHCO3 |
| D、相同条件下与酸反应的剧烈程度:Na2CO3>NaHCO3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com