
古诗词是古人为我们留下的宝贵精神财富,下列诗句不涉及氧化还原反应的是( )
A.野火烧不尽,春风吹又生 B.春蚕到死丝方尽,蜡炬成灰泪始干
C.粉身碎骨浑不怕,要留青白在人间 D.爆竹声中一岁除,春风送暖入屠苏
 作业辅导系列答案
作业辅导系列答案 同步学典一课多练系列答案
同步学典一课多练系列答案 经典密卷系列答案
经典密卷系列答案科目:高中化学 来源: 题型:
用Cl2生产某些含氯有机物时会产生副产物HC1。利用反应A,可实现氯的循环利用。反应A:4HCl+O2
 2Cl2+2H2O
2Cl2+2H2O
(1)已知:Ⅰ反应A中, 4mol HCI被氧化,放出115.6kJ的热量。
Ⅱ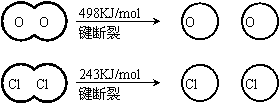

H2O的电子式是_______________.
②反应A的热化学方程式是_______________。
③断开1 mol H—O 键与断开 1 mol H—Cl 键所需能量相差约为__________KJ,H2O中H—O 键比HCl中H—Cl键(填“强”或“若”)_______________。
(2)对于反应A,下图是4种投料比[n(HCl):n(O2),分别为1:1、2:1、4:1、6:1、]下,反应温度对HCl平衡转化率影响的曲线。


①曲线b对应的投料比是______________.
②当曲线b, c, d对应的投料比达到相同的HCl平衡转化率时,对应的反应温度与投
料比的关系是_________________.
③投料比为2:1、温度为400℃时,平衡混合气中Cl2的物质的量分数是_______________.
查看答案和解析>>
科目:高中化学 来源: 题型:
下列热化学方程式或离子方程式中,正确的是:
A.甲烷的标准燃烧热为-890.3kJ·mol-1,则甲烷燃烧的热化学方程式可表示为:
CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H=-890.3kJ·mol-1
B. 500℃、30MPa下,将0.5mol N2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:
 △H=-38.6kJ·
△H=-38.6kJ· mol-1
mol-1
C. 氯化镁溶液与氨水反应:
D. 氧化铝溶于NaOH溶液: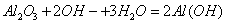
查看答案和解析>>
科目:高中化学 来源: 题型:
J、L、M、R、T是原子序数依次增大的短周期主族元素,J、R在周期表中的相对位置如右表;J元素最低负化合价的绝对值与其原子最外层电子数相等;M是地壳中含量最多的金属元素。
(1)M的离子结构示意图为_____;元素T在周期表中位于第_____族。
(2)J和氢组成的化合物分子有6个原子,其结构简式为______。
(3)M和T形成的化合物在潮湿的空气中冒白色烟雾,反应的化学方程式为_____。
(4)L的最简单气态氢化物甲的水溶液显碱性。
①在微电子工业中,甲的水溶液可作刻蚀剂H2O2 的清除剂,所发生反应的产物不污染环境,其化学方程式为______。
②一定条件下,甲在固定体积的密闭容器中发生分解反应(△H>0)并达平衡后,仅改变下表中反应条件x,该平衡体系中随x递增y递减的是_______(选填序号)。
| 选项 | a | b | c | d |
| x | 温度 | 温度 | 加入H2的物质的量 | 加入甲的物质的量 |
| y | 甲的物质的量 | 平衡常数K | 甲的转化率 | 生成物物质的量总和 |
(5)由J、R形成的液态化合物JR2 0.2mol在O2中完全燃烧,生成两种气态氧化物,298K时放出热量215k J。 该反应的热化学方程式为________。
J。 该反应的热化学方程式为________。
 (2)J和氢组成含有6个原子的分子为乙烯,其结构简式为
(2)J和氢组成含有6个原子的分子为乙烯,其结构简式为
(3)M和T形成的化合物为 ,与水反应
,与水反应 ,其中氯化氢气体呈雾状
,其中氯化氢气体呈雾状
(4)①氨水与双氧水发生氧化还原反应: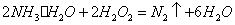
生成无污染的氮气;
②甲在固体体积的密闭容器中发生分解反应 ,
, 表明正反应为吸热反应,升高温度,平衡朝着正方向移动,甲物质的量减少;加入
表明正反应为吸热反应,升高温度,平衡朝着正方向移动,甲物质的量减少;加入 的物质的量即增加生成物的浓度,平衡朝逆方向移动,甲的转化率减小
的物质的量即增加生成物的浓度,平衡朝逆方向移动,甲的转化率减小
(5)JR2为CS2,燃烧生成二氧化碳和二氧化硫,依题意可以很快的写出反应的热化学方程式

查看答案和解析>>
科目:高中化学 来源: 题型:
某学生做完实验后,采用下列方法清洗所用仪器:
①用浓氨水清洗做过银镜反应后的试管
②用酒精清洗做过碘升华的烧杯
③用浓盐酸清洗做过高锰酸钾分解实验的试管
④用盐酸清洗长期存放三氯化铁溶液的试剂瓶
⑤用氢氧化钠溶液清洗盛过苯酚的试管
⑥用热氢氧化钠的浓溶液清洗沾有硫磺的试管
下列对以上操作的判断。正确的是 ( )
A.除①外都对 B.除⑥外都对 C.④⑤不对 D.全都正确
查看答案和解析>>
科目:高中化学 来源: 题型:
将Mg、Cu组成的混合物26.4g投入到适量的稀硝酸中,固体完全溶解,收集到标准状况下的NO气体8.96L,向反应后的溶液中加入过量的5mol·L-1的NaOH溶液300mL,金属离子完全沉淀。则形成沉淀的质量是 ( )
A.43.2g B. 46.8g C. 53.6g D. 63.8g
查看答案和解析>>
科目:高中化学 来源: 题型:
Fe(OH)3+3H+=Fe2++3H2O
硫铁矿烧渣(主要成分为 Fe2O3、Fe3O4、FeO、SiO2等)是生产硫酸的工业废渣,其综合利用对环境保护具有现实意义。利用硫铁矿烧渣制备铁红等产品的实验流程如下:
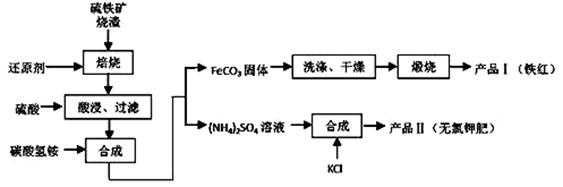
 已知几种盐的溶解度随温度变化的
已知几种盐的溶解度随温度变化的
曲线如右图所示:
回答下列问题:
(1)酸浸、过滤后滤液中的金属阳离子
是______________。
(2)煅烧 FeCO3生成产品 I的化学反应
方程式为 _______。实验室进行煅烧操作所
需仪器除了酒精喷灯、泥三角、三脚架、玻
璃棒外,还有__________。
(3)产品Ⅱ的化学式为 _______________,为了获得产品Ⅱ,向 (NH4)2SO4溶液中加入KCl溶液后,还需要进行的操作是: 。
(4)检验产品 II中是否含有氯化物杂质的实验操作是:取少量产品Ⅱ于试管中配成溶液, 。
查看答案和解析>>
科目:高中化学 来源: 题型:
BaCl2·xH2O中结晶水数目可通过重量法来确定:
①称取1.222g样品,置于小烧杯中,加入适量稀盐酸,加热溶解,边搅拌边滴加稀硫酸到沉淀完全,静置;
② 过滤并洗涤沉淀;
过滤并洗涤沉淀;
③将盛有沉淀的滤纸包烘干并中温灼烧;转入高温炉中,反复灼烧到恒重,称得沉淀质量为1.165g。
回答下列问题:
(1)在操作②中,需要先后用稀硫酸和 洗涤沉淀;检验沉淀中氯离子是否洗净的方法是 。
(2)计算BaCl2·xH2O中的x= (要求写出计算过程)。
(3)操作③中,如果空气不充足和温度过高,可能会有部分沉淀被滤纸中的碳还原为BaS,这使x的测定结果 (填“偏低”、“偏高”或“不变”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com