
 N2O4(g) ��H<0���ֽ�һ����NO2��N2O4�Ļ������ͨ�����Ϊ2 L�ĺ����ܱ������У���Ӧ��Ũ����ʱ��仯��ϵ����ͼ��ʾ��
N2O4(g) ��H<0���ֽ�һ����NO2��N2O4�Ļ������ͨ�����Ϊ2 L�ĺ����ܱ������У���Ӧ��Ũ����ʱ��仯��ϵ����ͼ��ʾ��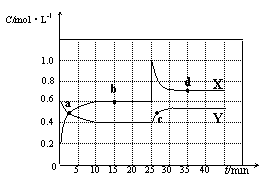
 N2O4(g)��b���ƽ�ⳣ��K(b)= ��
N2O4(g)��b���ƽ�ⳣ��K(b)= �� N2O4(g)��d���ƽ�ⳣ��K(d)��b���ƽ�ⳣ��K(b)�Ĺ�ϵ��
N2O4(g)��d���ƽ�ⳣ��K(d)��b���ƽ�ⳣ��K(b)�Ĺ�ϵ��| A��������� | B����С������� |
| C������һ������NO2 | D������һ������N2O4 |

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 H2(g)��I2(g)����H��0����t1ʱ�ﵽƽ�⣬t2ʱ�������²����£���t3ʱ�ִﵽ��ƽ�⣬������һ�仯��ͼ���� ( )
H2(g)��I2(g)����H��0����t1ʱ�ﵽƽ�⣬t2ʱ�������²����£���t3ʱ�ִﵽ��ƽ�⣬������һ�仯��ͼ���� ( )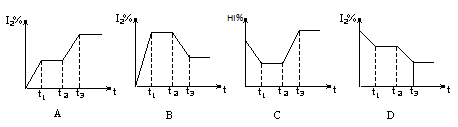
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A����ƽ�ⳣ������ʽ�У���Ӧ���Ũ��Ϊ��ʼŨ�ȣ��������Ũ��Ϊƽ��Ũ�� |
| B�����κ������£���ѧƽ�ⳣ������һ���㶨ֵ |
| C��ƽ�ⳣ���Ĵ�Сֻ��Ũ���йأ����¶ȡ�ѹǿ���������� |
| D����ƽ�ⳣ���Ĵ�С�����ж�һ����Ӧ���еij̶� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
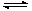 2B(g)+C(g) ����H>0��Ҫʹ�淴Ӧ��������A��Ũ�ȼ�С��ֻ�ı�һ����������Ӧ��ȡ�Ĵ�ʩ�ǣ� ��
2B(g)+C(g) ����H>0��Ҫʹ�淴Ӧ��������A��Ũ�ȼ�С��ֻ�ı�һ����������Ӧ��ȡ�Ĵ�ʩ�ǣ� ��| A����ѹ | B������ | C��������ʵĴ��� | D������B��Ũ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
 FeO(s) �� CO(g) + Q kJ
FeO(s) �� CO(g) + Q kJ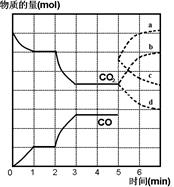
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A�����¡���ѹʱ������NH3 | B�����¡�����ʱ������N2 |
| C�����¡���ѹʱ������He | D�����¡�����ʱ������He |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 CO2��H2(g) ��Ӧ�����вⶨ�IJ������ݼ��±�������t2��t1��:
CO2��H2(g) ��Ӧ�����вⶨ�IJ������ݼ��±�������t2��t1��:| ��Ӧʱ��/min | n(CO)/mol | n(H2O)/ mol |
| 0 | 1.20 | 0.60 |
| t1 | 0.80 | |
| t2 | | 0.20 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������


 �����£�Cr(OH)3���ܶȻ�Ksp=10-32����c(Cr3+)����10-5mol/L����Ϊc(Cr3+)�Ѿ���ȫ�������ֽ��ڢ۲���Һ��pHֵ����4����ͨ������˵��Cr3+�Ƿ������ȫ����д��������̣�
�����£�Cr(OH)3���ܶȻ�Ksp=10-32����c(Cr3+)����10-5mol/L����Ϊc(Cr3+)�Ѿ���ȫ�������ֽ��ڢ۲���Һ��pHֵ����4����ͨ������˵��Cr3+�Ƿ������ȫ����д��������̣�
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com