
| A. | 苯在常温下可与溴水发生取代反应 | |
| B. | 糖类、油脂和蛋白质都能发生水解反应 | |
| C. | 乙醇和乙酸都能与金属钠反应 | |
| D. | 葡萄糖能发生氧化反应和银镜反应 |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | KMnO4 | B. | KClO3 | C. | MnO2 | D. | Ca(ClO)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径 Na<Mg<Al | B. | 酸性 H2SiO3<H2CO3<H2SO4 | ||
| C. | 稳定性 HF<HCl<HBr | D. | 碱性 NaOH<Mg(OH)2<Al(OH)3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
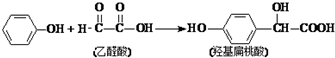
| A. | 该反应是取代反应 | |
| B. | 苯酚和羟基扁桃酸遇上FeCl3溶液都会显色 | |
| C. | 乙醛酸与H2加成的产物能在催化剂作用下形成高分子化合物 | |
| D. | 1mol羟基扁桃酸能与3mol NaOH反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 参加反应的氯气的物质的量等于$\frac{1}{2}$amol | |
| B. | 改变温度,产物中KC1O3的最大理论产量为1/7amol | |
| C. | 若某温度下,反应后$\frac{c(C{l}^{-})}{c(Cl{O}^{-})}$=11,则溶液中$\frac{c(C{l}^{-})}{c(Cl{O}^{-})}$=$\frac{1}{2}$ | |
| D. | 改变温度,反应中转移电子的物质的量ne的范围:$\frac{1}{2}$amol≤ne≤$\frac{5}{6}$amol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ②④⑤ | C. | ①②④ | D. | ②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 编号 | 叙述I | 叙述Ⅱ |
| A | Ksp(CaCO3)<Ksp(CaSO4) | 用Na2CO3溶液和盐酸除水垢CaSO4 |
| B | 金属钠有还原性 | 用金属钠检验无水乙醇中是否含有少量水 |
| C | 金属活动性铜比铁弱 | 镀铜铁制品表层划损后仍然受到保护 |
| D | Cl2具有漂白性 | 用氯气制盐酸 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com