
分析 (1)根据碘化亚铜的溶度积计算出碘离子的浓度;
(2)根据化合价升降相等配平反应方程式;高锰酸钾能够将碘离子氧化成碘单质;
(3)I2+2S2O32-=2I-+S4O62-反应结束时,溶液中碘单质消失,溶液变成无色;
(4)根据题中反应找出关系式2MnO4-~5C2O42- 2S2O32-~I2~2Cu2+,利用滴定数据求出n(C2O42-)、n(Cu2+),然后利用电荷守恒求出钾离子的物质的量,再利用样品质量算出水的物质的量,最后计算出样品晶体的组成.
解答 解:解:(1)CuI的Ksp=1.27×10-12=c(Cu+)•c(I-),c(I-)=$\frac{Ksp}{c(C{u}^{+})}$=$\frac{1.27×1{0}^{-12}}{c(C{u}^{+})}$,由于溶液中c(Cu+)≤1.0×10-6mol•L-1,c(I-)≥1.27×10-6,
故答案为:1.27×10-6;
(2)锰元素化合价+7→+2,降低了5价,生成氧气,氧元素化合价-2→0,升高了2×2=4,所以锰离子前配4,氧气前配5,再利用观察法配平其它物质,反应的离子方程式是:4MnO4-+12H+ $\frac{\underline{\;\;△\;\;}}{\;}$4Mn2++5O2↑+6H2O;若不加热除去高锰酸根离子,高锰酸根离子能够氧化碘离子,使得碘单质的物质的量增加,测定铜离子含量偏高,
故答案为:4MnO4-+12H+ $\frac{\underline{\;\;△\;\;}}{\;}$4Mn2++5O2↑+6H2O;偏高;
(3)根据反应I2+2S2O32-=2I-+S4O62-,当反应结束时,溶液的蓝色消失变成无色溶液,所以滴定终点是:溶液由蓝色变为无色,且半分钟内不变色,
故答案为:溶液由蓝色变为无色,且半分钟内不变色;
(4)根据反应2MnO4-+5C2O42-+16H+=2Mn2++8H2O+10CO2↑、2Cu2++4I-=2CuI↓+I2 I2+2S2O32-=2I-+S4O62-
可得关系式:2MnO4-~5C2O42-
2 5
0.2×8×10-3mol n(C2O42-)
2S2O32-~I2~2Cu2+
2 2
0.25×8×10-3mol n(Cu2+)
所以n(C2O42-)=4×10-3mol,n(Cu2+)=2×10-3mol,
根据电荷守恒原理:n(K+)=2n(C2O42-)-2n(Cu2+)=4×10-3mol
根据质量守恒原理:m(H2O)=0.6720-39×4×10-3-64×2×10-3-88×4×10-3=0.036g
n(H2O)=2×10-3,n (K+):n(Cu2+):n(C2O42-):n (H2O)=2:1:2:1,
所以样品晶体组成是:K2Cu(C2O4)2•H2O,
答:该样品晶体的化学式为:K2Cu(C2O4)2•H2O.
点评 本题考查了探究物质组成方法,题目的综合性较强,计算量稍大,充分考查了学生分析、理解信息、利用信息的能力,本题难度中等.


科目:高中化学 来源: 题型:选择题
| A. | SiO2与所有的酸都不能发生反应 | |
| B. | 将CO2、SO2通入Ca(ClO)2溶液均发生反应且反应类型相同 | |
| C. | 过量的铜与浓硝酸反应能生成NO气体 | |
| D. | 加盐酸产生能使澄清石灰水变浑浊气体的钠盐为Na2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子式为C2H6O的有机化合物性质相同 | |
| B. | 相同条件下,等质量的碳按a、b两种途径完全转化,途径a比途径b放出更多热能 途径a:C$→_{高温}^{H_{2}O}$CO+H2$→_{燃烧}^{O_{2}}$CO2+H2O 途径b:C$→_{燃烧}^{O_{2}}$CO2 | |
| C. | 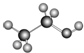 可以表示乙醇分子的球棍模型 可以表示乙醇分子的球棍模型 | |
| D. |  :既可以表示甲烷分子,也可以表示四氯化碳分子 :既可以表示甲烷分子,也可以表示四氯化碳分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
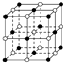 已知NaCl的摩尔质量为Mg•mol-1,晶体的密度为d g•cm-3,如图中Na+与最邻近的Cl-的核间距离为x cm,那么阿伏加德罗常数的值可表示为( )
已知NaCl的摩尔质量为Mg•mol-1,晶体的密度为d g•cm-3,如图中Na+与最邻近的Cl-的核间距离为x cm,那么阿伏加德罗常数的值可表示为( )| A. | 2Mx3d | B. | $\frac{M}{(2{x}^{3}d)}$ | C. | $\frac{4M}{({x}^{3}d)}$ | D. | $\frac{M}{({N}_{A}{x}^{3})}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铜溶于0.5 mol﹒L-1的硝酸中:Cu+4H++2NO3-═Cu2++2NO2↑+2H2O | |
| B. | 工业上将Cl2通入石灰乳中制漂白粉:Cl2+2OH-═Cl-+ClO-+H2O | |
| C. | 向Ba(OH)2溶液中加入少量的NH4HSO4溶液:Ba2++OH-+H++SO42-═BaSO4↓+H2O | |
| D. | 1.0mol/L的NaAlO2溶液和2.5mol/L的盐酸等体积混合:2AlO2-+5H+═Al3++Al(OH)3↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将煤汽化和液化,得到清洁的燃料和化工原料 | |
| B. | 用CO2合成聚碳酸酯等可降解塑料,减少白色污染 | |
| C. | 加强生活污水的脱氮除磷的处理,遏制水体富营养化 | |
| D. | 研究采煤、采油新技术,尽量提高其产量以满足工业生产快速发展的需求 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | [Ag(NH3)2]OH的溶液中加入盐酸:Ag++Cl-═AgCl↓ | |
| B. | NaAlO2溶液中通入过量的CO2:2AlO2-+3H2O+CO2═2Al(OH)3↓+CO32- | |
| C. | 用Na2S2O3溶液吸收自来水中多余Cl2:4Cl2+S2O32-+5H2O═10H++2SO42-+8Cl- | |
| D. | 向酸性KMnO4溶液滴加H2C2O4(弱酸),溶液褪色:2MnO4++5H2C2O4═2Mn2++10CO2↑+2H2O+6OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 单质的颜色随核电荷数的增加而加深 | |
| B. | 单质的熔、沸点随核电荷数的增加而升高 | |
| C. | 它们的氢化物的还原性随核电荷数的增加而增强 | |
| D. | 它们的氢化物的稳定性随核电荷数的增加而增强 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com