
| A. | X的能量一定低于M的能量,Y的能量一定低于N的能量 | |
| B. | 破坏反应物中的化学键所吸收的能量小于形成生成物中化学键所放出的能量 | |
| C. | X和Y的总能量一定低于M和N的总能量 | |
| D. | 因为该反应为吸热反应,故反应一定要加热才能进行 |
分析 A.反应热取决于反应物与生成物的总能量,而不是某一种反应物或生成物的能量关系;
B.反应物的总能量低于生成物的总能量时反应是吸热反应;
C.反应中断键时吸收的能量比形成化学键时放出的能量高,则反应是吸热反应;
D.吸热反应不一定在加热的条件下发生.
解答 解:A.X+Y=M+N为是一个吸热反应,说明反应物的能量低于生成物的总能量,不能说明X的能量一定低于M的能量,Y的能量一定低于N的能量,故A错误;
B、反应中断键时吸收的能量比形成化学键时放出的能量高,根据能量守恒可知,一部分能量储存在物质中,则反应是吸热反应,故B错误;
C、X+Y=M+N为是一个吸热反应,说明反应物的能量低于生成物的总能量,即X和Y的总能量一定低于M和N的总能量,故C正确;
D、吸热反应不一定在加热的条件下发生,比如氯化铵和十水合氢氧化钡的反应就是吸热反应,但是不需条件就能发生,故D错误.
故选C.
点评 本题考查吸热反应与放热反应,可以根据能量守恒从反应物与生成物的总能量、化学键的断裂与形成,进行理解,难度不大.


 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案 名校提分一卷通系列答案
名校提分一卷通系列答案 课程达标测试卷闯关100分系列答案
课程达标测试卷闯关100分系列答案科目:高中化学 来源: 题型:推断题
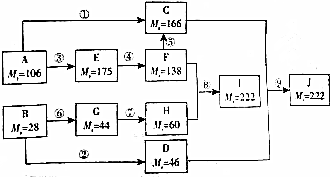
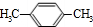 ,BCH2=CH2.
,BCH2=CH2.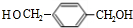 $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$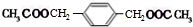 +2H2O.
+2H2O.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X>Z>Y>W | B. | Z>X>Y>W | C. | Z>Y>X>W | D. | Z>W>X>Y |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 放电时PbO2为正极,反应的离子方程式为:PbO2+4H++2e-+SO42-═PbSO4+2H2O | |
| B. | 充电时Pb电极为阴极,反应的离子方程式为:PbSO4+2e-═Pb+SO42- | |
| C. | 放电时电解质溶液密度不断减小,可根据电解液密度来判断是否需要充电 | |
| D. | 充电时可直接使用交流电源,不需要充电器也可充入 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | E(5s)>E(4f)>E(4s)>E(3d) | B. | E(4f)>E(3d)>E(4s)>E(3p) | C. | E(5d)>E(4d)>E(3d)>E(2d) | D. | E(5s)>E(4s)>E(4f)>E(3d) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (1)25℃时,pH=2的某酸HnA(A为酸根)与pH=12的某碱B(OH)m等体积混合,混合液的pH变为6.生成的正盐中存在着一定水解的离子,该离子水解的离子方程式为An-+H2O?HA(n-1)-+OH-.
(1)25℃时,pH=2的某酸HnA(A为酸根)与pH=12的某碱B(OH)m等体积混合,混合液的pH变为6.生成的正盐中存在着一定水解的离子,该离子水解的离子方程式为An-+H2O?HA(n-1)-+OH-.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com