
如图所示,取16.8 g碳酸氢钠在试管中加热,回答下列问题

(1)反应的化学方程式________.
(2)实验过程中,澄清石灰水的现象________.
(3)实验结束时,应先________,再________.
(4)加热到不再有气体生成,剩余固体是________,其质量为________g.
物质的量是________mol.
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
| H2C2O4 | KHC2O4 | K2C2O4 | |
| pH | 2.0 | 3.1 | 8.1 |
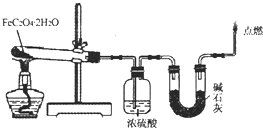
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
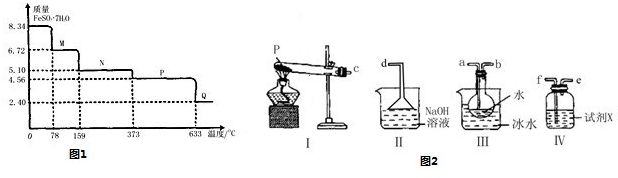
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解

| 温度(℃) | 60 | 240 | 930 | 1000 |
| 残留固体质量(g) | 19.7 | 16.1 | 8.1 | 8.1 |
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
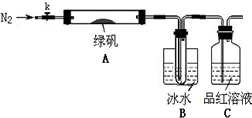
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com