
【题目】.某化学小组为了研究外界条件对化学反应速率的影响,进行了如下实验:
(实验原理)2KMnO4+5H2C2O4+3H2SO4=2MnSO4+10CO2↑+K2SO4+8H2O
(实验内容及记录)
实验 编号 | 室温下,试管中所加试剂及其用量/mL | 室温下溶液颜色褪至无色所需时间/min | |||
0.6mol/L H2C2O4 溶液 | H2O | 0.2mol/LKMnO4溶液 | 3mol/L稀硫酸 | ||
1 | 3.0 | 2.0 | 1.0 | 2.0 | 4.0 |
2 | 2.0 | 3.0 | 1.0 | 2.0 | 5.2 |
3 | 1.0 | 4.0 | 1.0 | 2.0 | 6.4 |
请回答:
(1)根据表中的实验数据,可以得到的结论是____。
(2)利用实验1中数据计算,所在时间内用KMnO4的浓度变化表示的平均反应速率为:v(KMnO4)=____。
(3)该小组同学根据经验绘制了n(Mn2+)随时间变化趋势的示意图,如图1所示。但有同学查阅已有的实验资料发现,该实验过程中n(Mn2+)随时间变化的趋势应如图2所示。该小组同学根据图2所示信息提出了新的假设,并继续进行实验探究。
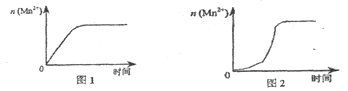
①该小组同学提出的假设是____。
②请你帮助该小组同学完成实验方案,并填写表中空白。
实验 编号 | 室温下,试管中所加试剂及其用量/mL | 再向试管中加入少量固体 | 室温下溶液颜色褪至无色所需时间/min | |||
0.6mol/LH2C2O4溶液 | H2O | 0.2mol/LKMnO4溶液 | 3mol/L稀硫酸 | |||
4 | 3.0 | 2.0 | 1.0 | 2.0 | ___ | t |
③若该小组同学提出的假设成立,应观察到的现象是______。
【答案】其他条件相同时,增大H2C2O4浓度(或反应物浓度),反应速率增大 6.25×10-3mol/(Lmin) 生成物中的MnSO4为该反应的催化剂(或Mn2+对该反应有催化作用) MnSO4 与实验1比较,溶液褪色所需时间短或所用时间(t)小于4min
【解析】
(1)利用控制变量法进行分析,发现草酸浓度是唯一变量;
(2)求出浓度变化和时间变化,相除即得;
(3)对比两个图象,发现右图突然陡升,所以考虑催化剂作用,即考虑产物中有催化剂,然后利用控制变量法设计实验对比即可。
(1)当研究某个外界条件改变对化学反应速率的影响时,要控制其它量不变。从表格中的实验数据可以看出,加上水的体积,3个实验所加的液体体积均为8.0mL,从而保证了高锰酸钾和硫酸的浓度均相同,唯一的变量就是草酸浓度。所以结合表中的时间数据可以得到的结论是:当其它条件相同时,增大反应物H2C2O4的浓度,反应速率增大;
(2)高锰酸钾溶液褪至无色,说明高锰酸钾已完全反应,所以高锰酸钾溶液的浓度改变量为:0.2mol/L×0.001L÷0.008L=0.025mol/L,时间耗用4min,所以用高锰酸钾表示的反应速率为0.025mol/L÷4min=6.25×10-3mol/(L·min);
(3)①对比两个图发现,右图反应速率一段时间后,忽然加快很多,考虑可能是产物对该反应起到了催化作用。推测是生成物中MnSO4(或Mn2+)对该反应有催化作用;
②从表格中所给的数据来看,显然是要与实验1作对比,比较在有Mn2+和没有Mn2+两种情况下,反应的快慢情况,所以需要加入MnSO4固体;
③若该小组同学提出的假设成立,则加入MnSO4固体后,反应会明显加快(高锰酸钾褪色所用的时间比实验1的4min要短很多)。


 全能测控一本好卷系列答案
全能测控一本好卷系列答案科目:高中化学 来源: 题型:
【题目】现有 100 mL 0.5 mol/LCa(CIO)2溶液,向其中缓慢通入CO2(如图所示)。下列说法错误的是

已知:①![]()
②溶液中粒子浓度可用以下公式计算:![]()
![]()
A.0.01 mol CO2通入溶液时发生反应的化学方程式为![]()
B.通入0.1 mol CO2后,用HNO3维持体系 pH=6,此时溶液中粒子浓度大小关系为c(HCO3-)>c(HCIO)>c(Ca2+)
C.迅速通入0.05 mol CO2后,关闭开关,久置后发现体系中沉淀减少
D.缓慢通入0.05 mol CO2的过程中,水的电离程度一直减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组变化中,前者小于后者的是( )
①CH4(g)+2O2(g)===CO2(g)+2H2O(l) ΔH1
CH4(g)+2O2(g)===CO2(g)+2H2O(g) ΔH2
②2H2(g)+O2(g)═2H2O(l) ΔH1
H2(g)+![]() O2(g)===H2O(l) ΔH2
O2(g)===H2O(l) ΔH2
③t ℃时,在一定条件下,将1 mol SO2和1 mol O2分别置于恒容和恒压的两个密闭容器中,达到平衡状态时分别反应放出的热量
④CaCO3(s)===CaO(s)+CO2(g) ΔH1
CaO(s)+H2O(l)===Ca(OH)2(s) ΔH2
A. ①②③ B. ②④ C. ②③④ D. ③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛是一种银白色的过渡金属,有良好的抗腐蚀性,是强度重量比最高的金属。请回答下列问题:
⑴基态钛原子核外共有_____个填充了电子的原子轨道,其外围电子的轨道表达式为_____。
⑵金属钛有两种同素异形体。
①在较高温度时具有体心立方晶胞,其空间利用率为_______(用含π的式子表示)。
②在较低温度时,采用面心立方最密堆积,其晶胞中有若干个正四面体空隙(如下图中a、b、c、d四个钛原子形成一个正四面体,其内部为正四面体空隙),可以填充其他原子。若晶胞中所有的正四面体空隙中都填充1个氢原子,则形成的氢化钛的化学式为________。
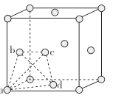
⑶金属钛的熔点、硬度均比铝大,可能的原因是_______。
⑷TiCl4是氯化法制取钛的中间产物。TiCl4和SiCl4在常温下都是液体,分子结构相同。采用蒸馏的方法分离TiCl4和SiCl4的混合物,先获得的馏分是_______(填化学式)。
⑸有机合成中某种含钛催化剂的结构如图所示。
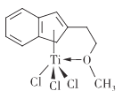
①组成该催化剂的元素中,电负性最大的是____(填元素名称)。
②该催化剂中碳原子的杂化方式为_____。
⑹配合物[TiCl(H2O)5]Cl2的配位数是__, 向含1 mol该配合物的水溶液中加入足量AgNO3溶液,可生成AgCl沉淀的物质的量为__。
⑺腈化钛(TiCN)可用于制备空气净化材料,已知氰气分子[(CN)2]中所有原子均满足最外层8电子稳定结构,则氰气分子中σ键和π键的个数比为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】N2分子在催化剂的作用下发生的一系列转化如图所示。下列叙述正确的是( )
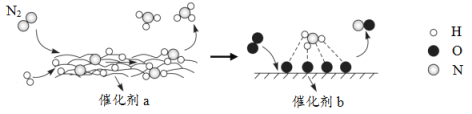
A.![]() 在反应过程中作催化剂
在反应过程中作催化剂
B.催化剂a表面发生了分解反应和化合反应
C.催化剂a、b增大了该历程中的最大能垒(活化能)
D.催化剂b表面发生的反应为:4NH3+5O2![]() 4NO+6H2O
4NO+6H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关热化学方程式的叙述中,正确的是( )
A. 含20.0gNaOH的稀溶液与足量的稀硫酸完全中和,放出28.7kJ的热量,则表示中和热的热化学方程式为2NaOH(aq)+H2SO4(aq)=Na2SO4(aq)+2H2O(l) △H=-114.8kJ·mol-1
B. 已知热化学方程式:SO2(g)+![]() O2(g)
O2(g)![]() SO3(g) △H=-98.32kJ·mol-1,在容器中充入2molSO2和1molO2充分反应,最终放出的热量为196.64kJ
SO3(g) △H=-98.32kJ·mol-1,在容器中充入2molSO2和1molO2充分反应,最终放出的热量为196.64kJ
C. 已知2H2(g)+O2(g)=2H2O(g) △H=-483.6kJ·mol-1,则H2的燃烧热为241.8kJ·mol-1
D. 已知石墨转化为金刚石为吸热,那么石墨比金刚石稳定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Fe(NO3)3是一种重要的媒染剂和金属表面处理剂,易溶于水、乙醇,微溶于硝酸,具有较强的氧化性。某学习小组利用如图装置制备Fe(NO3)3并探究其性质。
回答下列问题:
步骤一:制备Fe(NO3)3
a中加入100mL8mol·L-1硝酸,b中加入5.6g铁屑,将硝酸与铁屑混合后水浴加热。
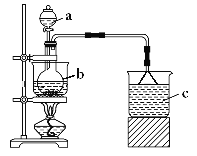
(1)仪器b的名称是___。
(2)反应过程中观察到b中铁屑溶解,溶液变黄色,液面上方有红棕色气体产生,仪器b中反应的离子方程式是___。
(3)c中所盛试剂是___,倒扣漏斗的作用是___。
(4)若要从反应后的溶液中得到Fe(NO3)3晶体,应采取的操作是:将溶液蒸发浓缩、冷却结晶、过滤、用____洗涤、干燥。
步骤二:探究Fe(NO3)3的性质
i.测得0.1mol·L-1Fe(NO3)3溶液的pH约等于1.6。
ii.将5mL0.1mol·L-1Fe(NO3)3溶液倒入有银镜的试管中,约1min后银镜完全溶解。
(5)使银镜溶解的原因可能有两个:a.NO3(H+)使银镜溶解;b.__使银镜溶解。为证明b成立,设计如下方案:取少量银镜溶解后的溶液于另一支试管中,___。
查看答案和解析>>
科目:高中化学 来源: 题型:
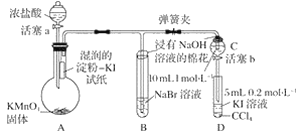
【题目】为验证卤素单质氧化性的相对强弱,某小组用下图所示装置进行实验(夹持仪器已略去,气密性已检验)。
实验过程:
Ⅰ.打开弹簧夹,打开活塞a,滴加浓盐酸。
Ⅱ.当B和C中的溶液都变为黄色时,夹紧弹簧夹。
Ⅲ.当B中溶液由黄色变为棕红色时,关闭活塞a。
Ⅳ.……
(1)验证氯气的氧化性强于碘的实验现象是_________________________________________。
(2)B中溶液发生反应的离子方程式是____________________________________________。
(3)为验证溴的氧化性强于碘,过程Ⅳ的操作和现象是________________________________。
(4)过程Ⅲ实验的目的是_________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示的电解装置可实现低电位下高效催化还原CO2。下列说法不正确的是( )
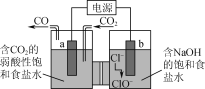
A.a极连接外接电源的负极
B.电解过程中Na+从右池移向左池
C.b极的电极反应式为Cl--2e-+H2O=ClO-+2H+
D.外电路上每转移1 mol电子,理论可催化还原标况下CO2气体11.2 L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com