
| A. | 1molNa与O2反应得到32g固体产物,钠失去电子数为NA | |
| B. | 用1mL0.1mol•L-1FeCl3溶液制得的氢氧化铁胶体所含胶粒数为10-4NA | |
| C. | 12g金刚石中含有的共价键数为2NA | |
| D. | 标准状况下,22.4LCH4中含有的碳原子数为NA |
分析 A.钠和氧气反应常温下生成氧化钠,加热条件下生成过氧化钠,依据反应的钠计算电子转移数;
B.氢氧化铁胶体微粒是由许多个氢氧化铁“分子”聚在一起形成的;
C.求出金刚石的物质的量,然后根据1mol金刚石中含2mol共价键来分析;
D.标准状况下,22.4LCH4物质的量=$\frac{22.4L}{22.4L/mol}$=1mol,含碳原子数1NA.
解答 解:A.1molNa与O2反应得到32g固体产物,钠全部反应失电子数为NA,故A正确;
B.氯化铁不能完全水解,胶粒是一种微粒的集合体,用1mL0.1mol•L-1FeCl3溶液制得的氢氧化铁胶体所含胶粒数小于10-4NA,故B错误;
C.12g金刚石的物质的量为1mol,而1mol金刚石中含2mol共价键即2NA个,故C正确;
D.标准状况下,22.4LCH4物质的量=$\frac{22.4L}{22.4L/mol}$=1mol,1mol甲烷中含碳原子1mol,则含碳原子数1NA,故D正确;
故选B.
点评 本题考查了阿伏伽德罗常的应用,主要考查质量换算物质的量计算微粒数、胶体的组成、物质中的化学键计算、电子转移计算、体摩尔体积的体积应用,综合性较强,题目难度中等.


 导学与测试系列答案
导学与测试系列答案 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案科目:高中化学 来源: 题型:多选题
| A. | 制备Fe(NO3)2溶液:将铁粉溶于过量的稀硝酸 | |
| B. | 提纯含有少量苯酚的苯:向含有少量苯酚的苯中加入过量氢氧化钠溶液,振荡后静置分液,并除去有机相的水 | |
| C. | 检验食盐中是否含有碘酸钾:取少量的食盐溶液,加稀硫酸酸化,再滴入淀粉溶液,观察实验现象 | |
| D. | 探究温度对化学平衡移动的影响:将盛有NO2和N2O4混合气体的平衡球,分别置于冷水和热水中,观察气体颜色的变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酸式滴定管用蒸馏水洗净后,直接加入已知物质的量浓度的盐酸 | |
| B. | 锥形瓶用蒸馏水洗净后再用NaOH润洗,再加人一定体积待测NaOH溶液 | |
| C. | 滴定时,没有逐出滴定管尖嘴的气泡,滴定后气泡消失 | |
| D. | 读数时,视线与滴定管内液体的凹液面最低处保持一致 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 1,2-二溴乙烷是常用的有机合成中间体,某小组用如图装置合成1,2-二溴乙烷.
1,2-二溴乙烷是常用的有机合成中间体,某小组用如图装置合成1,2-二溴乙烷.| 沸点/℃ | 密度/(g•cm-3) | 水中溶解性 | |
| 1,2二溴乙烷 | 131.4 | 2.18 | 微溶 |
| 溴 | 58.8 | 3.12 | 微溶 |
| 乙醇 | 78.5 | 0.79 | 溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X与Y可以形成5种以上的化合物 | |
| B. | M的氧化物对应的水化物的酸性一定比W的强 | |
| C. | W的气态氢化物与M的单质能发生置换反应 | |
| D. | Z、M的单质在一定探究下均能和强碱溶液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子式为C5H10 的烯烃 | B. | 分子式为C4H8O2的酯 | ||
| C. | 甲苯( 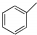 )的一氯代物 )的一氯代物 | D. | 立体烷 (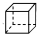 )的二氯代物 )的二氯代物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
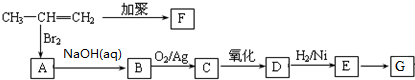
 .聚合物G的结构简式
.聚合物G的结构简式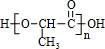 _
_ .
.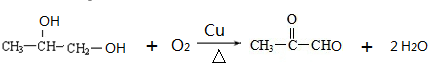 .
.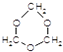 B.
B.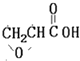 C.
C.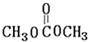 D.HOCH2CH2COOH.
D.HOCH2CH2COOH.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 根据以上信息,可推断CH3COOH为弱电解质 | |
| B. | 加水稀释过程中,c(H+)•c(OH-) 的值增大 | |
| C. | 加入NaOH固体可抑制 CHCOO-的水解 | |
| D. | 同pH的CH3COONa溶液和NaOH溶液,由水电离出的c(H+) 前者大 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 室温下向1 L pH=1的醋酸溶液中加水,所得溶液的OH-数目大于0.1NA | |
| B. | 60g乙酸与足量乙醇发生酯化反应,充分反应后乙酸断裂的C-O键数目为NA | |
| C. | 已知C2H4(g)+H2(g)=C2H6(g)△H=-137.0 kI/mol,乙烯与H2加成时放出68.5 kJ热量,则 反应过程中被破坏的碳原子之间共用电子对数目为NA | |
| D. | 4.6gSO2、NO2混合气体中含有中子数为2.3 NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com