
| A、Mg、NO2、O2 |
| B、MgO、NO2、O2 |
| C、Mg3N2、O2 |
| D、MgO、NO2、N2 |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、蛋白质、棉花、核酸、PVC、淀粉都是由高分子组成的物质 |
| B、合理开发利用可燃冰(固态甲烷水合物)有助于缓解能源紧缺 |
| C、红外光谱仪、核磁共振、质谱仪、分光光度计都可用于有机化合物官能团结构的分析 |
| D、造成大气污染的SO2、CO和NO,主要来源于化石燃料的燃烧和汽车尾气的排放 |
查看答案和解析>>
科目:高中化学 来源: 题型:
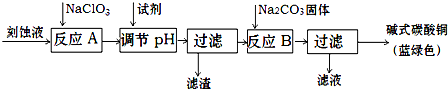
| 物质 | Cu(OH)2 | Fe (OH)2 | Fe (OH)3 |
| 开始沉淀pH | 4.2 | 5.8 | 1.2 |
| 完全沉淀pH | 6.7 | 8.3 | 3.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、(NH4)2SO4和CuSO4溶液都能使蛋白质沉淀析出 |
B、苯酚与甲醛在酸性条件下生成酚醛树脂的结构简式为 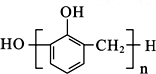 |
| C、醋酸和硬脂酸互为同系物,C6H14和C9H20也一定互为同系物 |
D、迷迭香酸的结构为 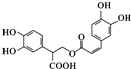 它可以发生酯化、水解、加成等反应 它可以发生酯化、水解、加成等反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| A、电解时,石墨作阳极,不锈钢作阴极 |
| B、电解时的阳极电极反应式:I--6e-+3H2O=IO3-+6H+ |
| C、当电解过程中转移3 mol e-时,理论上可制得KIO3 107 g |
| D、电解一段时间后,电解质溶液的pH变小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
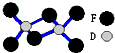 短周期元素A、B、C、D、E、F的原子序数依次增大,A与E、B与F属于同一主族,且A与E可以形成某种化合物X,其中A的质量分数为50%;C、D、F最高价氧化物对应的水化物两两之间都能反应,且C、D、F原子最外层电子数之和等于C的原子序数.则下列说法正确的是( )
短周期元素A、B、C、D、E、F的原子序数依次增大,A与E、B与F属于同一主族,且A与E可以形成某种化合物X,其中A的质量分数为50%;C、D、F最高价氧化物对应的水化物两两之间都能反应,且C、D、F原子最外层电子数之和等于C的原子序数.则下列说法正确的是( )| A、D、F两种元素能形成如图所示的二聚分子,则该化合物的化学式是D2F6,为离子化合物,在熔融状态下能导电 |
| B、B、F两元素形成的氢化物稳定性中,B的氢化物比较稳定,其原因为其分子间存在氢键 |
| C、将标况下22.4L的X加入到足量的水中,完全吸收后得1mol的对应的酸 |
| D、用电解法可制得C、D、F的单质 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| ||
| 编号 | 常温下反应 | 化学平衡常数 |
| 反应甲 | Au+6HNO3?Au(NO3)3+3NO2↑+3H2O | <10-5 |
| 反应乙 | Au3++4Cl-?[AuCl4]- | >105 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com