
| A、检验某溶液中是否含有Fe2+,向溶液中滴入氯水后,再滴加KSCN溶液 |
| B、除去HNO3溶液中混有少量H2SO4,加入适量BaCl2溶液,再过滤 |
| C、用相互滴加的方法鉴别HCl和NaHCO3溶液 |
| D、除去CO2中少量的HCl气体,将混合气体通过饱和NaHCO3溶液 |


科目:高中化学 来源: 题型:
| A、K+、Fe3+、CO32-、NO3- |
| B、H+、K+、MnO4-、Cl- |
| C、Ba2+、Na+、HCO3-、OH- |
| D、K+、Na+、SO42-、S2- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |

| 滴定次数 | 1 | 2 | 3 | 4 |
| KMnO4溶液体积/mL | 20.60 | 20.02 | 20.00 | 29.98 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①②⑨⑩ | B、③⑤⑥⑩ |
| C、③⑥⑦⑩ | D、④⑤⑧⑩ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 实验操作 | 实验现象 | 实验结论 |
| A | 向AgCl沉淀中滴加少量KI溶液 | 沉淀变为黄色 | Ksp(AgCl)>Ksp(AgI) |
| B | 向溶液X中加入盐酸酸化的BaCl2溶液 | 出现白色沉淀 | 溶液中一定含有SO42- |
| C | 在0.1mol?L-1Na2CO3溶液中,加两滴酚酞显浅红色,微热 | 红色加深 | 该水解是吸热反应 |
| D | 向溶液Y中加入稀盐酸,并将产生的无色气体通入澄清石灰水 | 有白色沉淀生成 | 溶液中可能含有CO32- |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、 所示装置,蒸干NH4Cl饱和溶液制备NH4Cl晶体 |
B、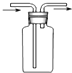 所示的气流方向可用于收集H2、NH3等 |
C、 所示装置,分离CCl4萃取I2水后的有机层和水层 |
D、 所示装置,可以证明氧化性:Cl2>Br2>I2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、除去粗盐中的Ca2+、Mg2+、SO42-,依次加入的物质是H2O、Na2CO3、Ba(OH)2、HCl |
| B、用铜和稀硝酸反应制取NO,并用排水法收集气体 |
| C、采用互相滴加的方法即可鉴别碳酸钠溶液和稀盐酸 |
| D、制备Fe(OH)2时,应将胶头滴管伸入FeSO4溶液中再挤压出氢氧化钠溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 实验目的 | 实验方案 |
| A | 验证Ksp(AgCl)>Ksp(AgI) | 向NaCl溶液中滴加少量AgNO3溶液,产生白色沉淀,再滴加KI溶液,可观察到白色沉淀转化为黄色沉淀 |
| B | 检验Fe(NO3)2晶体是否已氧化变质 | 将Fe(NO3)2样品溶于稀H2SO4后,滴加KSCN溶液,观察溶液是否变红 |
| C | 验证Br2的氧化性强于I2 | 将少量溴水加入KI溶液中,再加入CCl4,振荡,静置.可观察到下层液体呈紫色 |
| D | 比较确定铜和镁的金属活动性强弱 | 用石墨作电极电解Mg(NO3)2、Cu(NO3)2的混合液 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| C2H5ONa |
| 钠 | 苯 | 甲苯 | 对二甲苯 | 四氯化碳 | |
| 密度(g/cm3) | 0.97 | 0.88 | 0.87 | 0.86 | 1.60 |
| 熔点(℃) | 97.8 | 5.5 | -95 | 13.3 | -22.8 |
| 沸点(℃) | 881.4 | 80 | 111 | 138.4 | 76.8 |
| 无水硫酸钠 |
| 操作X |
| 水浴蒸馏 |
| 减压蒸馏 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com