
【题目】某小组探究“地康法制氯气”的原理并验证Cl2的性质,设计实验如下(夹持装置略去)请回答下列问题:
I. Cl2的制备。
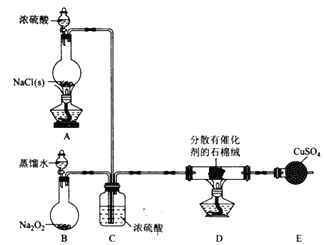
(1)装置B中发生反应的化学方程式为 ________________________________。
(2)装置C的作用除干燥气体外还有_______________________。
(3)装置 E中盛放CuSO4的仪器名称为_______________;反应开始后,硫酸铜变蓝,则装置D中发生反应的化学方程式为 _______________________________。
II.Cl2性质的验证。
该小组用实验I中制得的Cl2和如图所示装置(不能重复使用)依次验证干燥纯净的Cl2无漂白性、湿润的Cl2有漂白性、Cl的非金属性强于S
査阅资料:
①PdCl2溶液捕获CO时,生成金属单质和两种酸性气体化合物;
②少量CO2不干扰实验;
③该实验条件下,C与Cl2不反应。

(4)按气流从左到右的方向,装置连接的合理顺序为E→ → → → → → → →尾气处理(填装置字母)________________。
(5)试剂X的名称为________________。
(6)装置J中发生反应的化学方程式为______________________________________。
【答案】2Na2O2+2H2O=4NaOH+O2 控制气体的流速和比例、使气体混合均匀 (球形)干燥管 4HC1+O2![]() 2H2O+ 2C12 G(或L)KJL(或G )HFI 硫化钠溶液 PdCl2+CO+H2O=Pd+CO2+2HC1
2H2O+ 2C12 G(或L)KJL(或G )HFI 硫化钠溶液 PdCl2+CO+H2O=Pd+CO2+2HC1
【解析】
Ⅰ. (1)装置B中为过氧化钠与水反应生成氢氧化钠和氧气,化学方程式为:2Na2O2+2H2O=4NaOH+O2↑;综上所述,本题答案是:2Na2O2+2H2O=4NaOH+O2↑。
(2)装置C的作用除干燥气体外,还可以通过调节单位时间内的气泡数,控制气体的流速和比例、使气体混合均匀的作用;综上所述,本题答案是:控制气体的流速和比例、使气体混合均匀。
(3)由装置图可知,盛放CuSO4的仪器为(球形)干燥管;由信息知,加热条件下,HC1与O2反应生成氯气和水,可得方程式:4HC1+O2![]() 2H2O+ 2C12;综上所述,本题答案是:(球形)干燥管; 4HC1+O2
2H2O+ 2C12;综上所述,本题答案是:(球形)干燥管; 4HC1+O2![]() 2H2O+ 2C12 。
2H2O+ 2C12 。
II.(4)制得的Cl2中混有水蒸气、O2、HCl,用浓硫酸除去水蒸气,足量碳粉除去O2,生成的CO用PdCl2除去,同时HCl溶解于水中,且可溶性金属氯化物的溶液可降低Cl2的溶解度,再通过浓硫酸除去水蒸气;净化后的Cl2分别通过干燥的红纸条、湿润的红纸条、Na2S溶液,以验证Cl2的性质;所以装置的顺序应为E→G(或L)→K→J→L(或G)→H→F→I;综上所述,本题答案是:G(或L)KJL(或G )HFI。
(5)可用盐溶液中的置换反应来验证元素非金属性的强弱,氯气与硫化钠溶液反应生成单质硫,黄色沉淀,所以试剂X可以选用硫化钠溶液;综上所述,本题答案是:硫化钠溶液。
(6)装置J中发生的是PdCl2溶液捕获CO的反应,由信息可得方程式:PdCl2+CO+H2O=Pd+CO2+2HC1;综上所述,本题答案是:PdCl2+CO+H2O=Pd+CO2+2HC1。


科目:高中化学 来源: 题型:
【题目】在一定温度下的恒容容器中,当下列物理量不再发生变化时,表明反应: A(s)+3B(g)![]() 2C(g)+D(g)已达平衡状态的是
2C(g)+D(g)已达平衡状态的是
A. 混合气体的压强 B. 混合气体的密度 C. 体系的温度 D. 气体的总物质的量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验过程中产生的现象与对应的图形相符合的是( )
A. NaHSO3粉末加入HNO3溶液中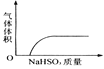 B. H2S气体通入氯水中
B. H2S气体通入氯水中
C. NaOH溶液滴入Ba(HCO3)2溶液中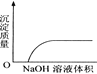 D. CO2通入澄清石灰水中
D. CO2通入澄清石灰水中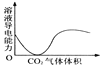
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请按要求,回答下列问题:
(1)同温同压下,0.3mol氧气和0.2mol臭氧的质量比为____。
(2)某气体的质量为3.4g,含有6.02×1022个分子,则该气体的摩尔质量为____
(3)标准状况下,89.6LHCl气体溶于1L水(ρ=1g/mL)中,所得盐酸的密度为1.09g/mL,则此盐酸的物质的量浓度为_____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为实现以下各步转化,请写出括号内应加入的试剂。
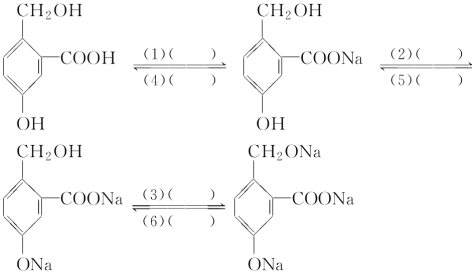
(1)________________;
(2)________________;
(3)________________;
(4)________________;
(5)________________;
(6)________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋约占地球表面积的71%,对其进行开发利用的部分流程如图所示。下列说法不正确的是( )

A. 可用BaCl2溶液除去粗盐中的SO42-
B. 从苦卤中提取Br2的反应的离子方程式为:2Br-+Cl2===2Cl-+Br2
C. 试剂1可以选用石灰乳
D. 工业上,电解熔融Mg(OH)2冶炼金属镁
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在实验室中可用下图所示装置制取氯酸钾、次氯酸钠和探究氯水的性质。

图中:①为氯气发生装置;②的试管里盛有15 mL 30%KOH溶液,并置于热水浴中;③的试管里盛有15 mL 8% NaOH溶液,并置于冰水浴中;④的试管里加有紫色石蕊试液;⑤为尾气吸收装置。
请填写下列空白:
(1)制取氯气时,在烧瓶里加入一定量的二氧化锰,通过________(填写仪器名称)向烧瓶中加入适量的浓盐酸。实验时为了除去氯气中的氯化氢气体,可在①与②之间安装盛有________(填写下列编号字母)的净化装置。
A.碱石灰 B.饱和食盐水
C.浓硫酸 D.饱和碳酸氢钠溶液
(2)本实验中制取次氯酸钠的离子方程式是_______________________。
(3)实验中可观察到④的试管里溶液的颜色发生了如下变化,请填写下表中的空白:
实验现象 | 原因 |
溶液最初从紫色逐渐变为___________色 | 氯气与水反应生成的H+使石蕊变色 |
随后溶液逐渐变为无色 | ___________________________ |
然后溶液从无色逐渐变为_________色 | ____________________________ |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】原电池原理的发现是储能和供能技术的巨大进步,是化学对人类的一项重大贡献。
(1)现有如下两个反应:A.NaOH+HCl=NaCl+H2O;B.Zn+H2SO4=ZnSO4+H2↑。上述反应中能设计成原电池的是______(填字母代号),负极Zn发生了_____反应(填“氧化”或“还原”)。
(2)将纯锌片和纯铜片按如图所示方式插入100 mL相同浓度的稀硫酸中一段时间,回答下列问题:

①下列说法正确的是_______(填字母代号)。
A.甲、乙均为化学能转变为电能的装置 B.乙中铜片上没有明显变化
C.甲中铜片质量减少、乙中锌片质量减少 D.两烧杯中溶液的pH均增大
②在相同时间内,两烧杯中产生气泡的速度:甲______乙(填“>”、“<“或“=”)。
③请写出图中构成原电池的装置负极的电极反应式___________。
④当乙中产生1.12 L(标准状况)气体时,将锌、铜片取出,再将烧杯中的溶液稀释至1 L,测得溶液中c(H+)=0.1 mol·L-1(设反应前后溶液体积不变)。试确定原稀硫酸的物质的量浓度为_______
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com