
| A. | 常温下,100 g 46%乙醇水溶液中含有H原子数为12Na | |
| B. | 23g Na与足量O2反应,生成Na2O和Na2O2的混合物,转移的电子数为Na | |
| C. | 标准状况下,2.24 L CC14含有的共价鍵数为0.4Na | |
| D. | l molN2与4molH2反应生成的NH3分子数小于2Na |
分析 A、在乙醇溶液中,除了乙醇外,水也含H原子;
B、求出钠的物质的量,然后根据钠反应后变为+1价来分析;
C、标况下四氯化碳为液体;
D、合成氨的反应为可逆反应.
解答 解:A、100 g 46%乙醇水溶液中,乙醇的质量为46g,物质的量为1mol,故含6molH原子;含有的水的质量为54g,物质的量为3mol,故含6molH原子,故溶液中含有的H原子个数共为12mol即12Na个,故A正确;
B、23g钠的物质的量为1mol,而钠反应后变为+1价,故1mol钠转移Na个电子,故B正确;
C、标况下四氯化碳为液体,故不能根据气体摩尔体积来计算其物质的量,故C错误;
D、合成氨的反应为可逆反应,不能进行彻底,故生成的氨气分子个数小于2Na个,故D正确.
故选C.
点评 本题考查了阿伏伽德罗常数的有关计算,难度不大,应注意掌握公式的运用和物质的结构.


科目:高中化学 来源: 题型:解答题
 按要求完成下列各题:
按要求完成下列各题:查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
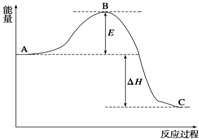 2SO2(g)+O2(g)?2SO3(g),反应过程的能量变化如图
2SO2(g)+O2(g)?2SO3(g),反应过程的能量变化如图查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | DNOP(邻苯二甲酸二辛脂)是一种由邻苯二甲酸和正辛醇经脂化反应而得的一种酯类有机化合物,常用作增塑剂、溶剂以及气相色谱固定液,对人体无害,可用作食品添加剂 | |
| B. | 铝及其合金是电气、工业、家底广泛使用的材料,是因为铝的冶炼方法比较简单 | |
| C. | 陶瓷、砖瓦、玻璃、水泥都是硅酸盐产品 | |
| D. | 白酒标签上注有“酒精度52%Vol”字样,它表示100g该白酒中含有52g洒精 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com