
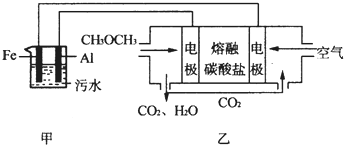
分析 (1)根据盖斯定律进行计算;
(2)①燃料电池中,正极上氧化剂得电子发生还原反应;熔融碳酸盐性质要稳定,高温时不能分解;
②铁作阳极,阳极上生成Fe2+,阴极附近生成氢氧根离子,氢氧根离子和Fe2+子生成Fe(OH)2沉淀,Fe(OH)2不稳定,易被氧化生成Fe(OH)3;
③c(Fe3+)=$\frac{{K}_{sp}}{{c}^{3}(O{H}^{-})}$;
④乙装置中阴极上甲醚失电子生成二氧化碳,根据CH3OCH3---2CO2---12e-计算n(CO2)=$\frac{0.24mol}{12}$=0.04mol,n(Na2S)=0.2mol/L×0.2L=0.04mol,根据电离平衡常数知发生反应CO2+S2-+H2O═HCO3-+HS-,再结合电荷守恒和物料守恒解答.
解答 解:(1)①H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=-285.5kJ/mol
②CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H=-283kJ/mol
③CH3OCH3(g)+3O2=2CO2(g)+3H2O(l)△H=-1460.0kJ/mol
用水煤气成分按1:1合成二甲醚,
将方程式3①+3②-③得:3H2(g)+3CO(g)=CH3OCH3(g)+CO2(g)△H=3(-285.5kJ/mol)+3(-283kJ/mol)-(-1460.0kJ/mol)=-245.5kJ/mol,
故答案为:3H2(g)+3CO(g)=CH3OCH3(g)+CO2(g)△H=-245.5kJ•mol-1;
(2)①燃料电池中,正极上氧化剂氧气得电子和二氧化碳发生还原反应生成碳酸根离子,电极反应式为O2+4e-+2CO2=2CO32-;熔融碳酸盐性质要稳定,高温时不能分解生成其它物质,
A.MgCO3高温下分解生成氧化镁和二氧化碳而得不到碳酸根离子,故错误;
B.Na2CO3性质较稳定,熔融状态下只发生电离而不发生分解反应,故正确;
C.NaHCO3性质不稳定,易分解而得不到碳酸根离子,故错误;
D.(NH4)CO3性质不稳定,易分解而得不到碳酸根离子,故错误;
故答案为:O2+4e-+2CO2=2CO32-;B;
②阳极上Fe失电子生成亚铁离子,阴极上生成氢氧根离子,亚铁离子和氢氧根离子反应生成氢氧化亚铁,氢氧化亚铁不稳定,被氧气氧化生成氢氧化铁,离子反应方程式为:4Fe2++O2+10H2O=4Fe(OH)3↓+8H+,
故答案为:4Fe2++O2+10H2O=4Fe(OH)3↓+8H+;
③c(Fe3+)=$\frac{{K}_{sp}}{{c}^{3}(O{H}^{-})}$=$\frac{4×1{0}^{-38}}{(\frac{1{0}^{-14}}{1{0}^{-5}})^{3}}$mol/L=4.0×10-11 mol/L,
故答案为:4.0×10-11mol/L;
④乙装置中阴极上甲醚失电子生成二氧化碳,根据CH3OCH3---2CO2---12e-计算n(CO2)=$\frac{0.12mol}{12}$=0.04mol,n(Na2S)=0.2mol/L×0.2L=0.04mol,根据电离平衡常数知发生反应CO2+S2-+H2O═HCO3-+HS-,则溶液中的溶质是等物质的量浓度的NaHCO3、NaHS,
A.根据以上分析知,发生反应的离子方程式为:CO2+S2-+H2O═HCO3-+HS-,故错误;
B.根据以上分析知,发生反应的离子方程式为:CO2+S2-+H2O═HCO3-+HS-,故正确;
C.根据物料守恒得c(Na+)=2[c(H2S)+c(HS-)+c(S2-)],故正确;
D.根据电荷守恒得c(Na+)+c(H+)=2c(CO32-)+2c(S2-)+c(OH-)+c(HS-)+c(HCO3-),故错误;
E.碳酸氢根离子和硫氢根离子都水解和电离,但程度都较小,钠离子不水解,根据电离平衡常数知,HCO3-水解程度小于HS-,所以离子浓度大小顺序是c(Na+)>c(HCO3-)>c(HS-)>c(OH-),故正确;
故答案为:BCE.
点评 本题考查较综合,涉及了盖斯定律、原电池原理、离子浓度大小比较等知识点,题目难度中等,明确燃烧热的内涵、原电池原理内涵、盐类水解与弱电解质电离关系即可解答,这些知识点都是高考热点,常常以综合题大题出现,涵盖了化学反应原理所有知识,利用教材基础知识采用知识迁移的方法进行解答.


科目:高中化学 来源: 题型:解答题
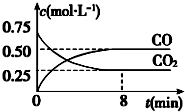 一定条件下铁可以和CO2发生反应:Fe(s)+CO2(g) FeO(s)+CO(g)△H>0,1100℃时,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,反应过程中CO2和CO的浓度与时间的关系如图所示.
一定条件下铁可以和CO2发生反应:Fe(s)+CO2(g) FeO(s)+CO(g)△H>0,1100℃时,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,反应过程中CO2和CO的浓度与时间的关系如图所示.| 甲 | 乙 | |
| 量 | 3mo Fe、 mo CO | mo FeO、 3mo CO |
| CO浓度(mo•-1) | c1 | c |
| CO体积分数 | φ1 | φ |
| 体系压强(Pa) | p1 | p |
| 气态转化率 | α1 | α |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(Na+)>c(HRO3-)>c(H+)>c(RO32-)>c(OH-) | |
| B. | c(Na+)+c(H+)═c(HRO3-)+c(RO32-)+c(OH-) | |
| C. | c(RO32-)+c(HRO3-)+c(H2RO3)═c(Na+) | |
| D. | 两溶液中c(Na+)、c(HRO3-)、c(RO32-)分别相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 乙酸 | B. | 乙醇 | C. | 水 | D. | 乙酸乙酯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3OH的燃烧热为192.9 kJ•mol-1 | |
| B. | 反应①中的反应物总能量大于生成物的总能量 | |
| C. | CH3OH转变成H2的过程一定要吸收能量 | |
| D. | 根据②推知反应:CH3OH(l)+1/2O2(g)=CO2(g)+2H2(g)的△H>-192.9kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | CO | H2 | CH3OH |
| 浓度(mol•L-1) | 0.9 | 1.0 | 0.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com