
����Ŀ����������ʵ��������������õ��Ľ�����ȷ����
ѡ�� | ʵ����������� | ʵ����� |
A |
| װ������������ |
B | �����������뵽������HI��Һ�У�����ܽ�μ����Ȼ�̼�����ã��²���Ϻ�ɫ�� | I2������ǿ��Fe3+ |
C | ��������ͭ�����зֱ�μ�����Ͱ�ˮ���������ܽ� | ������ͭΪ������������ |
D | ��SO2ͨ��Na2CO3��Һ�����ɵ����壬ͨ�����ʯ��ˮ���л��� | ˵�����ԣ�H2SO3��H2CO3 |
A.AB.BC.CD.D
���𰸡�A
��������
Aѡ�ͨ����������ע�����������̶���ij�������Թ���עˮû�������ܿں������ƻ������۲��Ƿ����������ж�װ�� �����ԣ���A��ȷ��
�����ԣ���A��ȷ��
Bѡ������������뵽������HI��Һ�У�����ܽ�μ����Ȼ�̼�����ã��²���Ϻ�ɫ��˵����������⻯�ⷴӦ�����˵��ʵ⣬Fe3+������ǿI2����B����
Cѡ���������ͭ�����μ����ᷢ������кͷ�Ӧ��������ͭ�Ͱ�ˮ��Ӧ�����İ���ͭ���Ӷ��ܽ⣬������ͭ�����������������C����
Dѡ�SO2��CO2����ʹ����ʯ��ˮ����ǣ��������������һ���ǻ��ǵģ�����˵��˭������ǿ������D����
������������ΪA��


 ��У����ϵ�д�
��У����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ӷ���ʽ��д��ȷ���ܺ������́~ʵ����
A. SO2����ˮ����.�γ�����:SO2+ H2O = 2H+ + SO32-
B. ��Mg(HCO3)2��Һ�м��˹���NaOH��Һ��������ɫ������Mg2+ +2HCO3- +2OH -= MgCO3��+2H2O
C. ����۵⻯����Һ�еμ�ϡ���ᣬ�ڿ����з��á���ʱ�����Һ������ 4H++4I-+O2=2I2+2H2O
D. Cl2ͨ��FeCl2 ��Һ������ FeCl3��Fe2++Cl2=2Cl-+Fe3+
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��500��ʱ�����ݻ�Ϊ2 L���ܱ������г���һ������CO��H2O��������Ӧ��CO(g)��H2O(g)![]() CO2(g)��H2(g) ����Ӧ�����вⶨ�IJ������ݼ���(����t2��t1)��
CO2(g)��H2(g) ����Ӧ�����вⶨ�IJ������ݼ���(����t2��t1)��
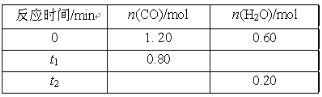
����˵����ȷ����
A.����ѹǿ�����淴Ӧ����û��Ӱ�죬ƽ�ⲻ�ƶ�
B.���������������䣬��ʼʱ�������г���0.60molCO��1.20molH2O(g)���ﵽƽ��ʱn(CO2)��0.40mol
C.���������������䣬��ƽ����ϵ����ͨ��0.20molH2O(g)����ԭƽ����ȣ��ﵽ��ƽ��ʱCOת��������H2O�������������
D.�ɱ��������ݵó���t1ʱ�̸÷�Ӧ��δ�ﵽƽ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��̼��þ������һ�������������β����е���ǿ����
ʵ��һ���ϳ�̼��þ����IJ��裺
������һ��Ũ�ȵ�MgSO4��Һ��NH4HCO3��Һ��
����ȡһ������NH4 HCO3��Һ�������У����貢��μ���MgSO4��Һ�������¶�50�棬��Ӧһ��ʱ�䣻
���ð�ˮ������ҺpH��9.5������һ��ʱ����ˡ�ϴ�ӡ������̼��þ�����Ʒ��
��ȡ3.000gMgSO4��Ʒ����250mL��Һ������ͼ��ʾ��
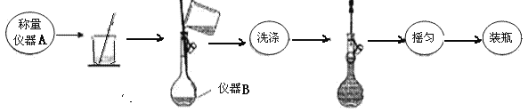
�ش��������⣺
��1��д��ʵ���������ƣ�A_____��B_____��������Һ�����ж��ݺ����ҡ������ʵ�����Ϊ______��
��2������̼��þ�����Ƿ�ϴ�ɾ��ķ�����_________��
ʵ������ⶨ��ƷMgCO3��nH2O�е�nֵ��������ҩƷ��ͼ��ʾ����
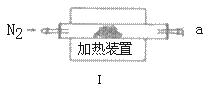
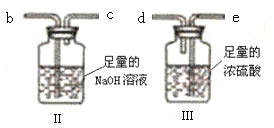
��3��ʵ���װ�õ�����˳��Ϊ_____�������������ýӿ���ĸabcde��ʾ�������Т�װ�õ�������_____��
��4������ǰ��ͨ��N2�ž�װ�â��еĿ�����Ȼ���ȡװ�â�ij�ʼ���������м���ʱ����ͨ��N2��������______��
��5����Ҫȷ�ⶨnֵ��������Ҫ�������������е�_____����ѡ����ĸ����д����Ӧ1������龰�£�����nֵ����ѧ����ʽ��n=______��
a��װ�â�Ӧǰ��������m1 b��װ�â�Ӧǰ��������m2 c��װ�â�Ӧǰ��������m3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������Ƥ�����Ƶ���Ҫ��ѧ�Լ���������ˮâ����Na2SO4����̿���ڸ����·�Ӧ���Ƶã���Ӧ����ʽ���£�Na2SO4+4C ��Na2S+ 4CO��Na2SO4+4CO��Na2S+4CO2
��1��������ˮâ��17.75g�������ɹ�������ˮâ����������Ϊ80%���������Ͽɵõ�Na2S_____g��������ɱ���µ�CO_____L��
��2�����ڷ�Ӧ���������ɵ�Na2S3mol�������ĵ�̼���ʵ����ʵ��� n�ķ�Χ��____mol��n��___mol�������ɵ����ʵ���CO��CO2�������ĵ�̼�����ʵ���Ϊ____mol��
��3��Na2S�����ڿ����У��ᱻ����������Na2SO4�� Na2SO3���ֳ�ȡ�Ѿ�����������������Ʒ78.40g����ˮ�У������������ᣬ��ַ�Ӧ����˵ó���19.20g���ų�H2S����2.24L����״����������㣺78.40g��Ʒ�и�������������ʵ���(д����Ҫ�ļ������)��_____
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ҹ�����ʹ�����ѺϽ���ϵĹ�����ĸ�ѳɹ���ˮ����(Ti)���������ᡢ�������Ӧ�����������ܱ�������������������(��Ҫ�ɷ���FeO��TiO2)��ȡ�����ѵ���Ҫ����������ͼ������˵���������( )
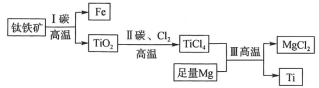
A.��������̼����ԭ��
B.��������δ����������ԭ��Ӧ
C.��������������������н��У���ֹ��������������
D.����ϡ�����ȥ�������е�����þ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ȷ��ʶ��ʹ�õ������������ÿһ���˵��ճ�����绯ѧ����SO2��Ŀǰ�о����ȵ㣬����˫��ˮ��������SO2��Ŀǰ�о����ȵ㡣
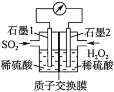
(1)��Ӧ���ܻ�ѧ����ʽΪ___�������ĵ缫��ӦʽΪ___��
(2)H����Ǩ�Ʒ���Ϊ��___��___(����������������)��
(3)��11.2L(��״��)SO2���뷴Ӧ����Ǩ��H�������ʵ���Ϊ___��
(4)���л�ѧ��ز�����ɻ�����Ⱦ����___(����ĸ)��
A.����ȼ�ϵ�� B.п�̵�� C.���ӵ�� D.Ǧ����
(5)ijͬѧ����ԭ��صıʼ��У�����������___(�����)��
��ԭ������缫������һ����ͬ
��ԭ��ظ������ϲ��뷴Ӧ���������϶������뷴Ӧ
��Fe-NaOH��Һ-Siԭ��أ�Fe�Ǹ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʯ����MgO��NiO��SiO2��Fe2O3��FeO�ȣ����������������������һ����������һ��������ʯΪԭ����ȡ����ͼ�ʽ̼����[Ni3��OH��4CO34H2O]��������ͼ��
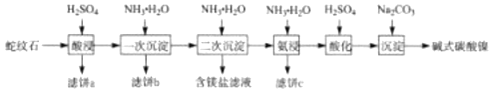
��֪����ʵ���¶��£���ͬpHʱ��������ɷּ��ȷֽ���
pH | ��������ɷ� | �ȷֽ���� |
2.5 | NH4Fe3��SO4��2��OH��6 | Fe2O3��SO2��SO3��NH3��O2��H2O |
3.5 | ��-FeOOH | Fe2O3��H2O |
���ֽ������ӳ�����pH��
Mg2+ | Fe2+ | Ni2+ | |
��ʼ������pH | 9.4 | 6.5 | 6.7 |
������ȫ��pH | 12.4 | 9.7 | 9.5 |
����������������Һ����Ҫ�ɷ�Ϊ[Ni��NH3��6]2+���Ҵ���[Ni��NH3��6]2+ Ni2++6NH3��ش�
��1���˱�a����Ҫ�ɷ�Ϊ___��
��2���˱�b��ϴ�ӡ����տɵ����졣��һ�γ�����ʱӦ����pH=__���2.5��3.5��������ԭ��Ϊ___��
��3����������ʱ����[Ni��NH3��6]2+�����ӷ���ʽΪ___���˹��̻�ͬʱ���� NH4HCO3����Ŀ��Ϊ___��
��4����������ǰ���ȡ��ữ������ƽ���ƶ�ԭ��������ԭ��Ϊ__��
��5��ʵ���Ҳ��Ni3��OH��4CO34H2O��M=377����Ʒ�ڿ���������ʱ��Ʒʧ���ʣ�ʧ����=������Ʒ��ʧ��������/��ʼ������Ʒ��������100%�����¶ȣ�T���Ĺ�ϵ��ͼ��ʾ��

��200oCʱ���ù���Ļ�ѧʽΪ___��
��250��350oC֮�䷴Ӧ�Ļ�ѧ����ʽΪ___��
��6����ʽ̼�����ɽ�һ��ת���Ƶ������ء������صĹ���ԭ��Ϊ��Ni��OH��2+M![]() NiOOH+MH��M��ʾ���������Ͻ𣩡��õ�س������������ĵ缫��ӦʽΪ___��
NiOOH+MH��M��ʾ���������Ͻ𣩡��õ�س������������ĵ缫��ӦʽΪ___��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ʊ�������������ɫ�ϳ�·��֮һΪ��
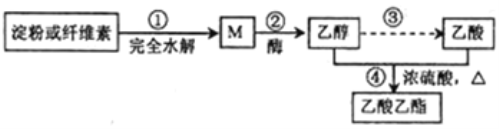
����˵������ȷ���ǣ�������
A. ���������£�M��������������ͭ����Һ������Ӧ
B. �ܵķ�Ӧ��������������Ӧ��Ҳ����ȡ����Ӧ
C. ���ۺ���ά�صĻ�ѧʽ��Ϊ��C6H10O5��n������Ϊͬ���칹��
D. �ñ���̼������Һ���Լ����Ҵ����������������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com