
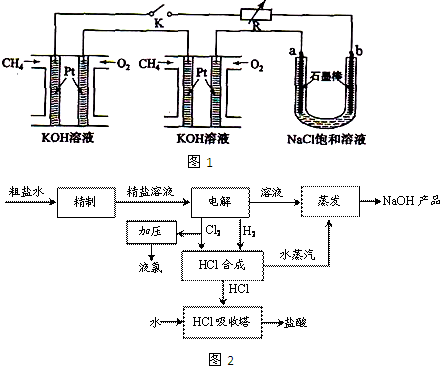
氯碱厂电解饱和食盐水制取NaOH的工艺流程示意图如下(见下图):

依据上图,完成下列填空:
(1)在电解过程中,与电源正极相连的电极上所发生反应的化学方程式为________与电源负极相连的电极附近,溶液pH________(填“不变”、“升高”或“下降”).
(2)工业食盐含Ca2+、Mg2+等杂质.精制过程中发生反应的离子方程式为________、________.
(3)如果粗盐中SO42-含量较高,必须添加钡试剂除去SO42-,该钡试剂可以是________(选填a、b、c).
a.Ba(OH)2
b.Ba(NO3)2
c.BaCl2
(4)为了有效除去Ca2+、Mg2+、![]() ,加入试剂的合理顺序为________(选填a、b、c).
,加入试剂的合理顺序为________(选填a、b、c).
a.先加NaOH,后加NaCO3,再加钡试剂
b.先加NaOH,后加钡试剂,再加NaCO3
c.先加钡试剂,后加NaOH,再加NaCO3
(5)脱盐工序中利用NaOH和NaCl在溶解度上的差异,通过________、冷却、________(填操作名称)除去NaCl.
(6)在隔膜法电解食盐水时,电解槽分隔为阳极区和阴极区,防止Cl2与NaOH反应;采用无隔膜电解冷却的食盐水时,Cl2和NaO充分接触,产物仅是NaClO和H2,相应的化学方程式为__________________________.
(1) 2Cl--2e===Cl2;升高; (2)Ca2++2OH-=Ca(OH) 2 (3) a、c; (4) b、c; (5)蒸发、过滤; (6) |
第(1)问要熟练运用电解原理,与电源正极相连的电极是电解池的阳极,应是溶液中的Cl-发生氧化反应,而电解池的阴极反应为2H++2e=H2
|


科目:高中化学 来源: 题型:
 2OH-+H2↑+Cl2↑
2OH-+H2↑+Cl2↑ 2OH-+H2↑+Cl2↑
2OH-+H2↑+Cl2↑ 2MgCl2(s)+Ti,在Ar气氛中进行的理由是:
2MgCl2(s)+Ti,在Ar气氛中进行的理由是:查看答案和解析>>
科目:高中化学 来源: 题型:

| ||
| ||
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
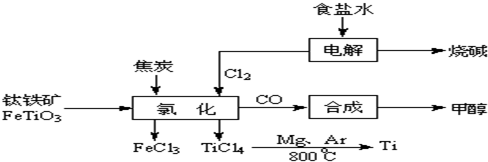
钛(Ti )被称为继铁、铝之后的第三金属。如下图所示,将钛厂、氯碱厂和甲醇厂组成产业链可以大大提高资源利用率,减少环境污染。请填写下列空白:
(l)电解饱和食盐水时,总反应的离子方程式是 。
(2)写出钛铁矿经氯化法得到四氯化钛的化学方程 。
(3)已知:①Mg(s)+ Cl2(g)=MgCl2(s) △H=-641kJ·mol-1
②Ti(s)+ 2Cl2(g)=TiCl4(s) △H= -770kJ·mol-1
则2Mg(s)+ TiCl4(s)=2MgCl2(s) + Ti(s) △H= 。
反应2Mg(s)+ TiCl4(s)![]() 2MgCl2(s)+ Ti,在Ar气氛中进行的理由是: ______________________________________ 。
2MgCl2(s)+ Ti,在Ar气氛中进行的理由是: ______________________________________ 。
(4)以甲醇、空气、氢氧化钾溶液为原料,石墨为电极可构成燃料电池。该电池中负极上的电极反应式是 。
查看答案和解析>>
科目:高中化学 来源:2012年山西省康杰中学高考理综模拟试题(三)理科综合化学试卷(带解析) 题型:填空题
(15分)钛(Ti)被称为继铁、铝之后的第三金属。如下图所示,将钛厂、氯碱厂和甲醇厂组成产业链可以大大提高资源利用率,减小环境污染。请填写下列空白:
(1)电解饱和食盐水时,该反应的离子方程式是____________________。
(2)已知:①Mg(s)+Cl2(g)=MgCl2(s);
②

则 ____________
____________
反应:

 在Ar气氛中进行的理由是________
在Ar气氛中进行的理由是________
(3)写出钛铁矿与焦炭、Cl2共热制得四氯化钛的化学方程式______________________
(4)以甲醇、空气、氢氧化钾溶液为原料,石墨为电极可构成燃料电池。已知该燃料电池的总反应式为:2CH3OH+3O2+4OH-=2CO32-+6H2O,该燃料电池发生反应时正极区溶液的PH_____(填“增大”、“减小”或“不变”)该电池中负极上的电极反应是__________.
(5)在上述产业链中合成96t甲醇理论上消耗H2_________t(不考虑生产过程中物质的任何损失)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com