
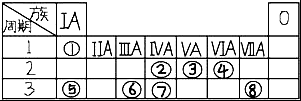
 表为元素周期表的一部分,请参照元素①⑧在表中的位置,回答下列问题:
表为元素周期表的一部分,请参照元素①⑧在表中的位置,回答下列问题:分析 由元素在周期表中位置,可知①为H、②为C、③为N、④为O、⑤为Na、⑥为Al、⑦为Si、⑧为Cl.
(1)①、③、④三种元素形成的既含离子键又含共价键的化合物为NH4NO3;与③同主族的短周期元素的最高价氧化物的水化物为磷酸;⑧的最高价氧化物的水化物为高氯酸;
(2)③、④、⑤、⑥形成的简单离子的电子层结构相同,核电荷数越大离子半径越小;
(3)⑤的最高价氧化物对应的水化物为NaOH,⑥的最高价氧化物反应为Al2O3,二者反应生成偏铝酸钠与水;
(4)同主族自上而下非金属性减弱,可以利用最高价含氧酸中强酸制备弱酸原理验证该.
解答 解:由元素在周期表中位置,可知①为H、②为C、③为N、④为O、⑤为Na、⑥为Al、⑦为Si、⑧为Cl.
(1)①、③、④三种元素可形成既含离子键又含共价键的化合物为NH4NO3,与③同主族的短周期元素的最高价氧化物的水化物为H3PO4;⑧的最高价氧化物的水化物为HClO4,
故答案为:NH4NO3;H3PO4;HClO4;
(2)电子层结构相同的离子,核电荷数越大离子半径越小,故离子半径:N3->O2->Na+>Al3+,
故答案为:N3->O2->Na+>Al3+;
(3)⑤的最高价氧化物对应的水化物为NaOH,⑥的最高价氧化物为Al2O3,二者反应生成偏铝酸钠与水,反应离子方程式为:Al2O3+2OH-═2AlO2-+H2O,
故答案为:Al2O3+2OH-═2AlO2-+H2O;
(4)同主族自上而下非金属性减弱,故非金属性C>Si,可以利用最高价含氧酸中强酸制备弱酸原理进行验证,反应离子方程式为:2CO2+SiO32-+2H2O=H2SiO3↓+2HCO3-,
故答案为:C;2CO2+SiO32-+2H2O=H2SiO3↓+2HCO3-.
点评 本题考查元素周期表与元素周期律应用,难度不大,注意掌握金属性、非金属性强弱比较实验事实.


科目:高中化学 来源: 题型:选择题
| 选项 | 离子组 | 分析 |
| A | 含大量Al3+的溶液中:K+、Na+、NO3-、CO32- | 不能大量共存,因有Al2(CO3)3沉淀生成 |
| B | 含大量Fe3+的溶液中:K+、Mg2+、I-、NO3- | 不能大量共存,因2Fe3++2I-=2Fe2++I2 |
| C | 由水电离的c(H+)=1×10-14mol/L的溶液中: Ca2+、NO3-、HCO3-、Cl- | 不能大量共存,因溶液呈酸性,与HCO3-反应产生CO2气体 |
| D | 使酚酞变红的溶液中: Na+、K+、SO32-、S2- | 不能大量共存,因SO32-和S2-反应产生淡黄色的S沉淀 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| X | ||||
| Z | W |
| A. | X和氢组成的化合物分子中可能含有极性共价键和非极性共价键 | |
| B. | 工业上用电解Y和W组成的化合物来制备Y | |
| C. | Z、W两元素的气态氢化物中,W的气态氢化物更稳定 | |
| D. | X、Y、Z、W元素最高价氧化物对应的水化物中酸性最强的是HWO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子半径:Y2->Z+ | |
| B. | 气态氢化物稳定性:HW>H2R | |
| C. | XW4分子中各原子均满足8电子稳定结构 | |
| D. | Y、Z、R三种元素组成的化合物只含有离子键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HCl MgCl2 NH4Cl | B. | H2O Na2O2 ? CO2 | ||
| C. | CaCl2 NaOH H2O | D. | CH4 H2O CS2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③ | B. | ②④ | C. | ②③ | D. | ④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 外界条件可以改变平衡状态 | B. | 达到平衡时正、逆反应速率相等 | ||
| C. | 平衡时各组分的含量也在不断变化 | D. | 该反应所建立的平衡是动态平衡 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
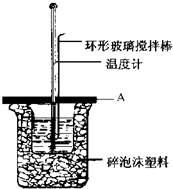 实验室用50mL 0.50mol•L-1盐酸、50mL 0.55mol•L-1NaOH溶液利用上图装置,进行测定中和热的实验.假设盐酸和氢氧化钠溶液的密度都是1g/cm3,又知中和后生成溶液的比热容c=4.18J/(g•℃).为了计算中和热,实验时还需测量的数据有(填序号)ACE.
实验室用50mL 0.50mol•L-1盐酸、50mL 0.55mol•L-1NaOH溶液利用上图装置,进行测定中和热的实验.假设盐酸和氢氧化钠溶液的密度都是1g/cm3,又知中和后生成溶液的比热容c=4.18J/(g•℃).为了计算中和热,实验时还需测量的数据有(填序号)ACE.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X单质在M单质中燃烧产生苍白色火焰,M最高价态含氧酸是已知的最强酸 | |
| B. | Z与W可生成W2Z和W2Z2,且W2Z2溶于水时,既有离子键、极性键、非极性键的断裂,又有离子键、极性键、非极性键生成 | |
| C. | X、Y、Z三种元素形成的化合物可能含离子键、共价键 | |
| D. | X与Z可形成10电子和18电子的化合物,分子中只含极性键 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com