
| A. | 用蒸馏水润湿的试纸测某溶液的pH,一定会使结果偏低 | |
| B. | 蒸馏操作时,冷却水应从冷凝管的下口通入,上口流出 | |
| C. | 分液时,分液漏斗下层液体从下口放出,上层液体从上口倒出 | |
| D. | 蒸发操作时,当有较多晶体析出时,停止加热 |
分析 A.需要根据溶液的酸碱性进行判断,如果溶液为酸性溶液,稀释后溶液的pH偏高,如果为中性溶液,溶液的pH不变;
B.蒸馏时,冷却水下进上出在冷凝管中的时间长;
C.分液时避免上下层液体混合;
D.蒸发时利用余热蒸干.
解答 解:A.用蒸馏水润湿的试纸测溶液的pH,若待测液为碱性溶液,则测定结果偏低;若待测液为中性溶液,测定结果不变,若待测液为酸性溶液,测定结果会偏高,所以测定结果不一定偏低,故A错误;
B.蒸馏时,冷却水下进上出在冷凝管中的时间长,则冷却效果好,故B正确;
C.分液时避免上下层液体混合,则分液漏斗下层液体从下口放出,上层液体从上口倒出,故C正确;
D.蒸发时利用余热加热,则应使混合物中有少量水后,停止加热,故D正确;
故选A.
点评 本题考查化学实验方案的评价,为高频考点,把握混合物分离实验操作为解答的关键,侧重分析与实验能力的考查,题目难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{100c}{a+b}$% | B. | $\frac{a}{a+b+c}$×100% | C. | $\frac{100c}{a+b-c}$% | D. | $\frac{100c}{a+b-\frac{c}{2}}$% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X3Y2 | B. | X2Y | C. | X2Y5 | D. | XY3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
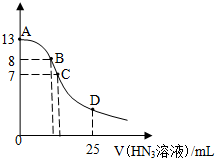 常温下向25mL0.1mol•L-1 NaOH溶液中逐滴滴加0.2mol•L-1的HN3溶液(叠氮酸),pH的变化曲线如图所示(溶液混合时体积的变化忽略不计,叠氮酸的Ka=10-4.7).下列说法正确的是( )
常温下向25mL0.1mol•L-1 NaOH溶液中逐滴滴加0.2mol•L-1的HN3溶液(叠氮酸),pH的变化曲线如图所示(溶液混合时体积的变化忽略不计,叠氮酸的Ka=10-4.7).下列说法正确的是( )| A. | A点水电离出的c(H+)小于B点 | |
| B. | 在B点,离子浓度大小为 c(OH-)>c(H+)>c(Na+)>c(N3-) | |
| C. | 在C点,滴加的V(HN3)=12.5mL | |
| D. | 在D点,c(H+)≈10-4.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
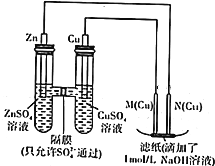 用如图示装置进行实验
用如图示装置进行实验查看答案和解析>>
科目:高中化学 来源: 题型:选择题
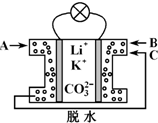 熔融碳酸盐燃料电池是一种高温电池,具有效率高、噪音低、无污染、燃料多样化、余热利用价值高和电池构造材料价廉等诸多优点,是未来的绿色电站.某种熔融碳酸盐燃料电池以Li2CO3、K2CO3为电解质、以CH4为燃料时,该电池工作原理见下图.下列说法正确的是( )
熔融碳酸盐燃料电池是一种高温电池,具有效率高、噪音低、无污染、燃料多样化、余热利用价值高和电池构造材料价廉等诸多优点,是未来的绿色电站.某种熔融碳酸盐燃料电池以Li2CO3、K2CO3为电解质、以CH4为燃料时,该电池工作原理见下图.下列说法正确的是( )| A. | Li+、K+移向左侧电极 | |
| B. | 外电路中电子由右侧电极移向左侧电极 | |
| C. | 通入1 mol气体A时,左侧电极上生成5 mol CO2 | |
| D. | 相同条件下通入气体B与气体C的体积比为2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电池工作时,电子由正极通过外电路流向负极 | |
| B. | 该电池反应中二氧化锰作正极,发生氧化反应 | |
| C. | 该电池工作时,电解液中的K+向锌极定向移动 | |
| D. | 电池负极的反应式为:Zn(s)-2e-+2OH-(aq)=Zn(OH)2(s) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com