
| A. | 电解水生成氢气和氧气时,电能转化为化学能 | |
| B. | 煤燃烧时化学能主要转化为热能 | |
| C. | 绿色植物进行光合作用时,太阳能转化为化学能 | |
| D. | 白炽灯工作时电能全部转变成光能 |
 探究与巩固河南科学技术出版社系列答案
探究与巩固河南科学技术出版社系列答案科目:高中化学 来源: 题型:解答题
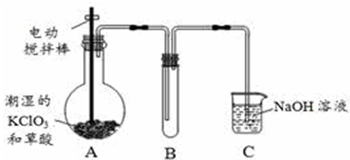
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
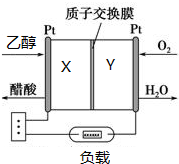 由于乙醇无毒,可再生人们对乙醇燃料电池的研究产生了兴趣.如图所示为某种乙醇燃料电池的工作原理,下列说法正确的是( )
由于乙醇无毒,可再生人们对乙醇燃料电池的研究产生了兴趣.如图所示为某种乙醇燃料电池的工作原理,下列说法正确的是( )| A. | Y极的电极反应式为O2+4e-+2H2O═4OH- | |
| B. | 电池放电时,H+由Y极区流向X极区 | |
| C. | 每消耗1mol乙醇,转移电子4mol | |
| D. | 用该电池做电源电解精炼铜,X极应与粗铜连接 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 431 kJ/mol | B. | 946 kJ/mol | C. | 649 kJ/mol | D. | 869 kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v(N2)═0.225 mol/(L•min) | B. | v(H2O)═0.375 mol/(L•min) | ||
| C. | v(O2)═0.225 mol/(L•min) | D. | v(NH3)═0.450 mol/(L•min) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3CH2CH2CH3和CH3CH=CHCH3 | B. | CH3CH=CHCH3和 CH3C≡CCH3 | ||
| C. | CH3CH=CHCH3和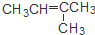 | D. | CH3CH2CH2OH和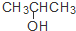 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com