
| A. | Na2SO4和NaCl的物质的量之比为1:3 | |
| B. | 溶液中一定有1molNa2SO4和3molNaCl | |
| C. | 所带电荷数SO42-是Na+的0.6倍 | |
| D. | SO42-与Cl-的物质的量之和等于Na+的物质的量 |
分析 Cl-的物质的量浓度是Na+的物质的量浓度的0.6倍,则设Cl-的物质的量浓度为0.6mol/L,可知Na+的物质的量浓度的1mol/L,即c(NaCl)=0.6mol/L,c(Na2SO4)=0.2mol/L,以此来解答.
解答 解:Cl-的物质的量浓度是Na+的物质的量浓度的0.6倍,则设Cl-的物质的量浓度为0.6mol/L,可知Na+的物质的量浓度的1mol/L,即c(NaCl)=0.6mol/L,c(Na2SO4)=0.2mol/L,
A.Na2SO4和NaCl的物质的量之比为0.2mol/L:0.6mol/L=1:3,故A正确;
B.溶液体积未知,不能计算物质的量,故B错误;
C.所带电荷数SO42-是Na+的$\frac{0.2}{1}$=0.2倍,故C错误;
D.SO42-与Cl-的物质的量浓度之和为0.8mol/L,Na+的物质的量浓度为1mol/L,SO42-与Cl-的物质的量之和不等于Na+的物质的量,故D错误;
故选A.
点评 本题考查物质的量的计算,为高频考点,把握物质的量与浓度、物质构成的关系为解答的关键,侧重分析与计算能力的考查,注意设出浓度简化计算,题目难度不大.


 金钥匙试卷系列答案
金钥匙试卷系列答案科目:高中化学 来源: 题型:选择题
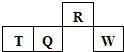 短周期元素R、T、Q、W在元素周期表中的相对位置如图所示,其中T所处的周期序数与族序数相等.下列判断不正确的是( )
短周期元素R、T、Q、W在元素周期表中的相对位置如图所示,其中T所处的周期序数与族序数相等.下列判断不正确的是( )| A. | 最简单气态氢化物的热稳定性:R<Q | |
| B. | 最高价氧化物对应水化物的酸性:Q<W | |
| C. | 原子半径:T>Q>R | |
| D. | 含T的盐T可以出现在酸根中 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
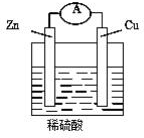 如图,将锌片和铜片用导线连接后加入稀硫酸溶液中,发生原电池反应,下列叙述错误的( )
如图,将锌片和铜片用导线连接后加入稀硫酸溶液中,发生原电池反应,下列叙述错误的( )| A. | 锌是负极,锌片逐渐溶解 | B. | 铜是正极,铜片上有气泡产生 | ||
| C. | 电流从锌片经导线流向铜片 | D. | 电子从锌片经导线流向铜片 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 操作及现象 | 结论 |
| A | 取少量溶液于试管中,滴加BaCl2溶液,有白色沉淀生成,加稀硝酸沉淀不溶解 | 溶液中含有Ag+或SO42- |
| B | 取少量溶液于试管中,滴加新制氯水,溶液由无色变为黄色 | 溶液中含有Br- |
| C | 取少量溶液于试管中,滴加浓氢氧化钠溶液,微热,试管口湿润的红色石蕊试纸变蓝 | 溶液中含有NH4+ |
| D | 取少量溶液于试管中,滴加新制氯水后再滴加KSCN溶液,溶液变红色 | 原溶液中含有Fe2+ |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 任何钠盐放人水中均不水解 | |
| B. | 可溶性铝盐溶于水都能水解 | |
| C. | NaC1水解后溶液呈中性 | |
| D. | NaHCO3溶液中只存在水解平衡不存在电离平衡 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com