
分析 (1)830K时,若起始时:c(CO)=2mol/L,c(H2O)=3mol/L,平衡时CO的转化率为60%,即转化的CO为2mol/L×60%=1.2mol/L,则
CO+H2O(g)?CO2+H2
开始 2 3 0 0
转化 1.2 1.2 1.2 1.2
平衡 0.8 1.8 1.2 1.2
K为生成物浓度幂之积与反应物浓度幂之积的比;
(2)温度不变,K不变,若只将起始时,c(H2O)改为6mol/L,则
CO+H2O(g)?CO2+H2
开始 2 6 0 0
转化 x x x x
平衡 2-x 6-x x x
K=$\frac{x×x}{(2-x)(6-x)}$,
(3)若830K时,起始浓度c(CO)=a mol/L,c(H2O)=b mol/L,H2的平衡浓度c(H2)=c mol/L
CO+H2O(g)?CO2+H2
开始 a b 0 0
转化 c c c c
平衡 a-c b-c c c
a=b时,$\frac{c×c}{(a-c)×(a-c)}$=K,以此来解答.
解答 解:(1)830K时,若起始时:c(CO)=2mol/L,c(H2O)=3mol/L,平衡时CO的转化率为60%,即转化的CO为2mol/L×60%=1.2mol/L,则
CO+H2O(g)?CO2+H2
开始 2 3 0 0
转化 1.2 1.2 1.2 1.2
平衡 0.8 1.8 1.2 1.2
K=$\frac{1.2×1.2}{0.8×1.8}$=1,水蒸气的体积分数为$\frac{1.8}{0.8+1.8+1.2+1.2}$×100%=30%,
故答案为:30%;1;
(2)温度不变,K不变,若只将起始时,c(H2O)改为6mol/L,则
CO+H2O(g)?CO2+H2
开始 2 6 0 0
转化 x x x x
平衡 2-x 6-x x x
K=$\frac{x×x}{(2-x)(6-x)}$=1,解得x=1.5,
则CO的转化率为$\frac{1.5mol}{2mol}$×100%=75%,
故答案为:75%;
(3)若830K时,起始浓度c(CO)=a mol/L,c(H2O)=b mol/L,H2的平衡浓度c(H2)=c mol/L
CO+H2O(g)?CO2+H2
开始 a b 0 0
转化 c c c c
平衡 a-c b-c c c
①由K可知,$\frac{c×c}{(a-c)×(b-c)}$=1,则a、b、c之间的关系式是ab=c(a+b),故答案为:ab=c(a+b);
②当a=b时,a与c的关系式为a=b时,$\frac{c×c}{(a-c)×(a-c)}$=K=1,则a与c的关系式为a=2c,故答案为:a=2c.
点评 本题考查化学平衡的计算,为高频考点,把握平衡三段法、转化率及K的计算为解答的关键,侧重分析与计算能力的考查,注意(3)为解答的难点,题目难度不大.


 金钥匙试卷系列答案
金钥匙试卷系列答案科目:高中化学 来源: 题型:实验题

| 实验步骤 | 预期现象 | 结论 |
| 取少量A中残留物于试管中,加入适量稀硫酸,充分振荡使其完全溶解;将溶液分成两份,分别滴加高锰酸钾溶液、KSCN溶液 | 若高锰酸钾溶液不褪色,加入KSCN溶液后变红 | 固体残留物仅为Fe2O3 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

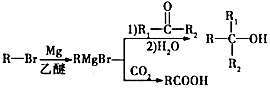
 ,其反应类型为取代反应.
,其反应类型为取代反应. .
. (写结构简式).
(写结构简式).
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 氢氧化物 | Al(OH)3 | Fe(OH)2 | Fe(OH)3 | Cu(OH)2 |
| 开始沉淀的pH | 4.0 | 5.8 | 1.1 | 5.4 |
| 完全沉淀的pH | 5.2 | 8.8 | 3.2 | 6.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| t℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com