
【题目】A-F 为中学化学常见物质,它们的焰色试验均为黄色。其中 A 为单质, B 与 C的组成元素相同,且 B 为淡黄色固体; D、 E、 F 的溶液均显碱性,其中 E 和 F 属于盐且相同物质的量浓度的溶液, E溶液的碱性更强。它们之间的相互转化关系如下图。(“![]() ”表示进一步反应即可转化,部分反应物、生成物和反应条件已略去)
”表示进一步反应即可转化,部分反应物、生成物和反应条件已略去)
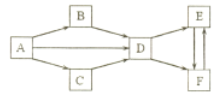
请回答下列问题:
(1)写出下列物质的化学式: B___, C___, E___。
(2)A![]() D 的化学方程式是_______________________。
D 的化学方程式是_______________________。
(3)B![]() D 的化学方程式是_______________________。
D 的化学方程式是_______________________。
(4)区分 E 和 F 两种固体的方法是:分别取等量的 E 和 F 两种固体少许于试管中,具体的操作现象和结论是_________________________。
【答案】Na2O2 Na2O Na2CO3 2Na + 2H2O = 2NaOH + H2↑ 2Na2O2 + 2H2O = 4NaOH + O2↑ 加热试管,将导气管插入澄清石灰水中E试管的澄清石灰水没有明显变化,F试管的澄清石灰水变浑浊,说明F是 NaHCO3,E 是 Na2CO3(或向两试管中分别加入等量的CaCl2溶液E试管中产生白色沉淀,F试管中无明显现象)
【解析】
A-F 为中学化学常见物质,它们的焰色试验均为黄色。其中 A 为单质,则A为Na; B 与 C的组成元素相同,且 B 为淡黄色固体,则B为Na2O2,C为Na2O; D、 E、 F 的溶液均显碱性,其中 E 和 F 属于盐且相同物质的量浓度的溶液, E溶液的碱性更强,D为NaOH,E为Na2CO3,F为NaHCO3,据此分析问题。
(1)根据上面分析可知:B为Na2O2, C为Na2O, E为Na2CO3。
答案:Na2O2;Na2O;Na2CO3;
(2)根据上面分析可知A为Na,D为NaOH,A![]() D 的化学方程式是2Na + 2H2O = 2NaOH + H2↑;
D 的化学方程式是2Na + 2H2O = 2NaOH + H2↑;
答案:2Na + 2H2O = 2NaOH + H2↑;
(3)根据上面分析可知B为Na2O2,D为NaOH ,B![]() D 的化学方程式是2Na2O2 + 2H2O = 4NaOH + O2↑;
D 的化学方程式是2Na2O2 + 2H2O = 4NaOH + O2↑;
答案:2Na2O2 + 2H2O = 4NaOH + O2↑;
(4)根据上面分析可知E为Na2CO3,F为NaHCO3,利用 2NaHCO3![]() Na2CO3+H2O+CO2而碳酸钠受热不分解或者利用Na2CO3+CaCl2=2NaCl+CaCO3↓而碳酸氢钠不与氯化钙反应进行区分;
Na2CO3+H2O+CO2而碳酸钠受热不分解或者利用Na2CO3+CaCl2=2NaCl+CaCO3↓而碳酸氢钠不与氯化钙反应进行区分;
答案:加热试管,将导气管插入澄清石灰水中E试管的澄清石灰水没有明显变化,F试管的澄清石灰水变浑浊,说明F是 NaHCO3,E 是 Na2CO3(或向两试管中分别加入等量的CaCl2溶液E试管中产生白色沉淀,F试管中无明显现象)。


 浙大优学小学年级衔接捷径浙江大学出版社系列答案
浙大优学小学年级衔接捷径浙江大学出版社系列答案科目:高中化学 来源: 题型:
【题目】某同学用下列装置进行有关Cl2的实验。下列说法不正确的是( )
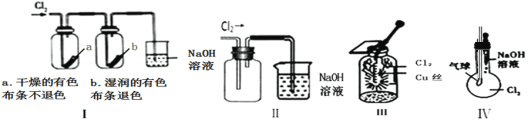
A.图I中:实验现象证明氯气无漂白作用,氯水有漂白作用
B.图II中:收集氯气
C.图IV中:若气球干瘪,证明可与NaOH溶液反应
D.图III中:生成棕黄色的烟,加少量水溶解得到蓝绿色溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把500mL含有BaCl2和KCl的混合溶液分成2等份,取一份加入含a mol 硫酸钠的溶液,恰好使钡离子完全沉淀;另取一份加入含b mol 硝酸银的溶液,恰好使氯离子完全沉淀。则该溶液中钾离子浓度为:
A.0.1(b-2a)mol/LB.10(b-2a)mol/L
C.10(2a-b)mol/LD.4(b-2a)mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验中,所使用的装置(部分夹持装置略)、试剂和操作方法都正确的是 ( )
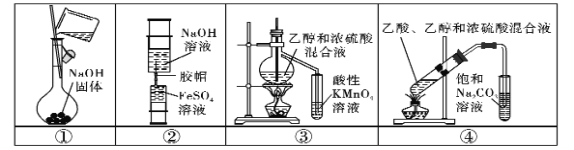
A.用装置①配制250 mL0.1 mol.L-1的NaOH溶液
B.用装置②制备少量Fe(OH)2固体
C.用装置③验证乙烯的生成
D.用装置④制取少量乙酸乙酯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于实验描述正确的是
A. 向浓氨水中滴加饱和![]() 溶液,可以制得
溶液,可以制得![]() 胶体
胶体
B. 为除去Mg(OH)2 固体中少量Ca(OH)2,可用饱和MgCl2溶液多次洗涤,再水洗、干燥
C. 向溶液 X 中加入足量盐酸,产生无色无味气体,将气体通入澄清石灰水,产生白色沉淀,说明溶液 X 中含有CO32-
D. 卤代烃Y与NaOH醇溶液共热后,恢复至室温,再滴加AgNO3 溶液,产生白色沉淀,说明卤代烃Y中含有氯原子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸钾(K2FeO4)是一种集氧化、吸附、絮凝于一体的新型多功能水处理剂。其生产工艺如下:

已知:
①2KOH+Cl2===KCl+KClO+H2O(条件:温度较低)
②6KOH+3Cl2===5KCl+KClO3+3H2O(条件:温度较高)
③2Fe(NO3)3+3KClO+10KOH===2K2FeO4+6KNO3+3KCl+5H2O
回答下列问题:
(1)该生产工艺应在______________(填“温度较高”或“温度较低”)情况下进行,从绿色化学的角度考虑通入氯气速率应________(填“较快”或“较慢”);
(2)写出工业上制取Cl2的化学方程式_____________;
(3)为了提高生活用水的卫生标准,自来水厂常使用高铁酸钾(K2FeO4)进行消毒、净化以改善水质,其原因是______
(4)配制KOH溶液时,是在每100mL水中溶解61.6g KOH固体(该溶液的密度为1.47 g/mL),它的物质的量浓度为____________(保留整数);
(5)在“反应液I”中加KOH固体的目的是__________:
A.与“反应液I”中过量的Cl2继续反应,生成更多的KClO
B.KOH固体溶解时会放出较多的热量,有利于提高反应速率
C.为下一步反应提供反应物
D.使副产物KClO3转化为 KClO
(6)该工艺每得到1.98 kg K2FeO4,理论上消耗Cl2的物质的量为___________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭真空容器中加入一定量纯净的氨基甲酸铵固体(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s) ![]() 2NH3(g)+CO2(g) ΔH>0。下列说法中正确的是( )
2NH3(g)+CO2(g) ΔH>0。下列说法中正确的是( )
A.密闭容器中气体的平均相对分子质量不变,则该反应达到平衡状态
B.密闭容器中气体的密度不变,则该反应达到平衡状态
C.再加入一定量氨基甲酸铵,可加快正反应速率
D.保持温度不变,压缩体积,可使正、逆反应速率都增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸亚铁铵晶体[(NH4)2Fe(SO4)2·6H2O]是分析化学中重要的试剂,常用于代替硫酸亚铁。硫酸亚铁铵晶体在500℃时隔绝空气加热完全分解。回答下列问题:
(1)硫酸亚铁铵晶体隔绝空气加热完全分解发生了氧化还原反应,固体产物可能有FeO和Fe2O3 ,气体产物可能有NH3、SO3、H2O、N2和__________。
(2)为检验分解产物的成分,设计如下实验装置进行实验,加热A中的硫酸亚铁铵晶体至分解完全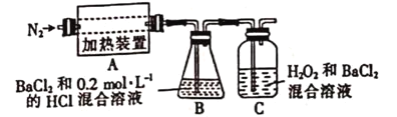
为检验A中残留物是否含有FeO,需要选用的试剂有____________(填标号)。
A.KSCN溶液 B.稀硫酸 C.浓盐酸 D.KMnO4溶液
(3)装置C中有不溶于酸的白色沉淀生成,则C中发生的化学反应的方程式为:____________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将0.65g的锌加到50mL 1mol/L 盐酸中发生如下反应:Zn+2HCl=ZnCl2+H2↑,生成0.224L的H2(标准状况下),则:
(1)填空:0.65g的锌的物质的量___________,生成的0.224L的氢气的物质的量___________,反应前盐酸的物质的量___________,实际参加反应的盐酸的物质的量___________,
(2)计算:若反应完成后体积不变,溶液中剩余盐酸的物质的量浓度_________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com