
| A. | 2s轨道可以和3p轨道形成sp2杂化轨道 | |
| B. | 烯烃中的碳碳双键由l个σ键和l个π键组成 | |
| C. | 由极性键组成的分子,一定是极性分子 | |
| D. | 甲烷中sp3杂化轨道的构型是平面正方形 |
分析 A.p轨道只有3个方向不同的轨道Px、Py、Pz,能形成sp2杂化,但轨道能量相近的轨道才能进行杂化杂化;
B.共价单键都是σ键,共价双键中一个是σ键一个是π键;
C.由同种原子构成的共价键是非极性键,不同原子构成的共价键是极性键,分子中正负电荷中心不重合,从整个分子来看,电荷的分布是不均匀的,不对称的,这样的分子为极性分子,反之为非极性分子;
D.根据价层电子对互斥理论确定中心原子杂化类型,价层电子对个数=σ键个数+孤电子对个数,甲烷分子的构型不是平面正方形.
解答 解:A.能量相近的轨道才能进行杂化杂化,如2S和2p、3s和3p等,2s轨道可以和3p轨道不能形成sp2杂化轨道,故A错误;
B.共价单键都是σ键,共价双键中一个是σ键一个是π键,共价三键中一个是σ键两个是π键,所以烯烃中的碳碳双键由l个σ键和l个π键组成,故B正确;
C.由极性键组成的分子,不一定是极性分子,如二氧化碳是直线型分子,分子对称,是极性键碳氧键形成的非极性分子,故C错误;
D.CH4中碳原子价层电子对个数=4+$\frac{4-4}{2}$=4,为sp3杂化,不含孤电子对,所以空间构型是正四面体形,故D错误;
故选B.
点评 本题考查了化学键、分子极性的判断、杂化等知识点,易错选项是A,注意并不是任意轨道间都能杂化,为易错点,题目难度中等.


 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案科目:高中化学 来源: 题型:解答题
| 序号 | 实验方案 | 实验现象 |
| ① | 向盛有少量溴化钠溶液的试管中滴加少量新制氯水,振荡,再加入少量四氯化碳,振荡后静置 | 液体分为两层,下层 呈橙红色 |
| ② | 向盛有少量碘化钠溶液的试管中滴加少量新制溴水,振荡,再加入少量四氯化碳,振荡后静置 | 液体分为两层,下层 呈紫红色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
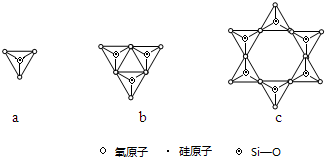
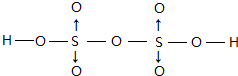 (配位键须注明).
(配位键须注明).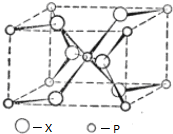
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 不仅有第2列元素的原子最外层有2个电子 | |
| B. | 第3~12列元素全为金属 | |
| C. | 第3列元素种类最多 | |
| D. | 第16、17列元素都是非金属元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲苯分子中的所有原子可能共平面 | B. |  分子中的所有原子可能共平面 分子中的所有原子可能共平面 | ||
| C. | 乙烷分子中的所有原子可能共平面 | D. | 二氯甲烷分子为正四面体结构 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
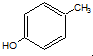 对甲基苯酚与溴水反应
对甲基苯酚与溴水反应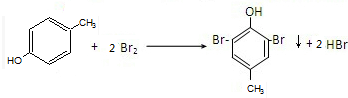
 环已二烯与氯气1,4加成
环已二烯与氯气1,4加成 +Cl2$\stackrel{催化剂}{→}$
+Cl2$\stackrel{催化剂}{→}$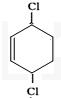
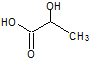 乳酸自酯化生成六元环状有机物CH3CH(OH)COOH$→_{△}^{浓硫酸}$
乳酸自酯化生成六元环状有机物CH3CH(OH)COOH$→_{△}^{浓硫酸}$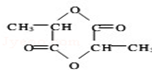 +2H2O
+2H2O .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com