
| A. | O2和S2O32-是氧化剂,Fe2+是还原剂 | |
| B. | 每生成1 mol Fe3O4,则转移电子2 mol | |
| C. | 氧化产物只有Fe3O4,还原产物只有S4O62- | |
| D. | 若有4 mol Fe2+被氧化,则被Fe2+还原的O2为1 mol |
分析 3Fe2++2S2O32-+O2+4OH-=Fe3O4+S4O62-+2H2O中,Fe元素的化合价由+2价升高为+3价,S元素的化合价升高,只有氧气中O元素的化合价降低,该反应中转移4e-,以此来解答.
解答 解:A.Fe、S元素的化合价升高,O元素的化合价降低,则O2是氧化剂,S2O32-和Fe2+是还原剂,故A错误;
B.每生成1molFe3O4,由O元素的化合价变化可知,转移电子数为1mol×2×(2-0)=4mol,故B错误;
C.Fe、S元素的化合价升高,S2O32-和Fe2+是还原剂,所以Fe3O4和S4O62-是氧化产物,故C错误;
D.若有4mol Fe2+ 参加反应,由电子守恒可知,则被Fe2+还原的O2为$\frac{4mol×(3-2)}{2×(2-0)}$=1mol,故D正确;
故选D.
点评 本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重电子转移及电子守恒的考查,注意选项C、D为解答的易错点,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:推断题
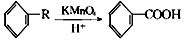 从A出发,发生图示中的一系列反应,其中B和C按1:2反应生成Z,F和E按1:2反应生成W,W和Z互为同分异构体.
从A出发,发生图示中的一系列反应,其中B和C按1:2反应生成Z,F和E按1:2反应生成W,W和Z互为同分异构体.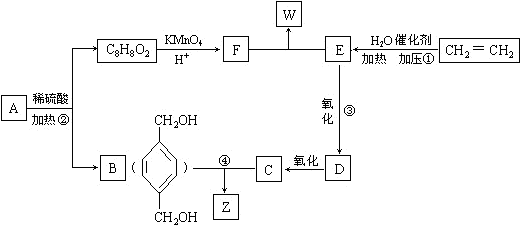
 +2CH3COOH$\stackrel{浓硫酸}{→}$
+2CH3COOH$\stackrel{浓硫酸}{→}$ +2H2O.
+2H2O.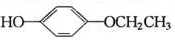 、
、 、
、 、
、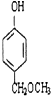 (任写两种)
(任写两种)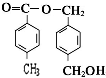 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用润湿的pH试纸测定稀碱溶液的pH,测定值偏小 | |
| B. | 用碱式滴定管量取22.00mL的KMnO4溶液 | |
| C. | 在未知液中滴加BaCl2溶液产生白色沉淀,加稀硝酸,沉淀不溶解,说明该未知液中一定含有SO42-或SO32- | |
| D. | 实验室制备氢氧化铁胶体的方法是将氢氧化钠稀溶液滴入饱和氯化铁溶液中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 镁粉中混有少量铝粉:加入过量烧碱溶液充分反应,过滤、洗涤、干燥 | |
| B. | 用过量氨水除去Fe3+溶液中的少量Al3+ | |
| C. | 用加热的方法出去苏打中少量的小苏打 | |
| D. | Al(OH)3中混有少量Mg(OH)2:加入足量烧碱溶液,充分反应,过滤,向滤液中通入过量CO2后过滤 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 己烷有4种同分异构体,它们的熔沸点不相同 | |
| B. | 在一定条件下,苯与液溴、硝酸作用生成溴苯、硝基苯的反应都属于取代反应 | |
| C. | 烷烃的通式为CnH2n+2,随n值增大,碳元素的质量百分含量逐渐增大 | |
| D. | 聚合物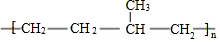 由单体CH3CH=CH2和CH2=CH2加聚制得 由单体CH3CH=CH2和CH2=CH2加聚制得 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁制品腐蚀时既可作正极也可作负极 | |
| B. | 铁制品腐蚀时铁电极发生反应为:Fe-3e-=Fe2+ | |
| C. | 铁制品腐蚀时或发生析氢腐蚀或发生吸氧腐蚀 | |
| D. | 铁制品连接电源正极可防止腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
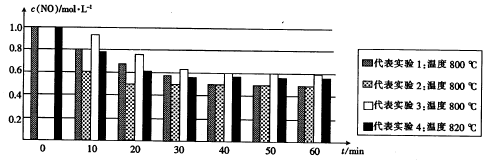
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com