
【题目】可逆反应:A(g)+B(g) ![]() C(s)+2D(g)的ΔH>0,下图所示为正逆反应速率(v)与时间(t)的关系,如果在t1时刻改变以下条件:①加入A;②加入催化剂;③加压;④升温;⑤移走C,符合图示的条件是( )。
C(s)+2D(g)的ΔH>0,下图所示为正逆反应速率(v)与时间(t)的关系,如果在t1时刻改变以下条件:①加入A;②加入催化剂;③加压;④升温;⑤移走C,符合图示的条件是( )。
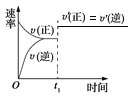
A. ②③B. ①②C. ③④D. ④⑤
科目:高中化学 来源: 题型:
【题目】有4种钠的化合物W、X、Y、Z,它们之间存在如下关系:
①W![]() X+H2O+CO2↑
X+H2O+CO2↑
②Z+CO2→X+O2
③Z+H2O→Y+O2↑
④X+Ca(OH)2→Y+CaCO3↓
试回答下列问题:
(1) W、X、Y、Z的化学式分别是:W:________,X:________,Y:________,Z:________。
(2)以上4个化学反应,属于氧化还原反应的是________(填反应序号),反应中氧化剂是________(写化学式)。
(3)若④反应在溶液中进行,写出其离子方程式以及能用该离子方程式表示的另一个化学反应的化学方程式:
①离子方程式:______________________________________________。
②化学方程式:________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化钙(CaO2)一种安全无的毒杀菌剂,以Ca(OH)2等为原料最终反应可制得CaO2。某化学研究性学习小组设计以下流程并探究不同条件对CaO2 制备的影响:
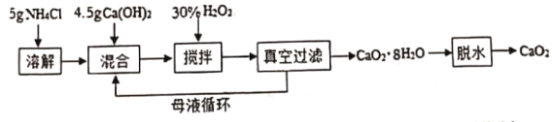
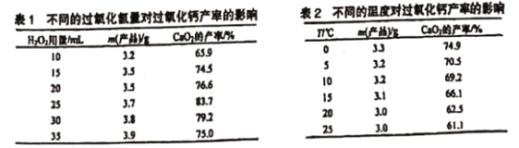
(1)搅拌过程中反应的化学反应方程式:___________________________。
(2)制备过界中除水外.可循环使用的物质是______________________。
(3)CaO2制备中H2O2合适的用量是__________________。
(4)该制备反应需控制温度在0~2℃,实验中可采取的措拖是 ___________ 。该温度下产率较高,其原因为__________________。
(5)CaO2样品中通常含有CaO,定量测定CaO2质量分数的实验方案为:_____。
(实验中可供选用的试剂有:氢氧化钠标准溶液、盐酸标准溶液、酚酞; 除常用仪器外须 使用的仪器有:电子天平、锥形瓶、滴定管)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一瓶无色澄清的溶液,其中可能含NH4+、K+、Na+、Mg2+、H+、Cu2+、CO32-、I-中的一种或几种,取该溶液进行如下实验:
①用PH试纸检验,表明溶液呈强酸性
②取部分溶液,加入少量的CCl4及数滴新制的氯水,振荡后CCl4层显紫色
③另取部分溶液,逐滴加入稀NaOH溶液,使溶液从酸性逐渐转变为碱性,在滴加过程中及滴加完毕后,溶液中均无沉淀生成
④将③得到的碱性溶液加热,有气体放出,该气体能使湿润的红色石蕊试纸变蓝。
根据上述实验事实确定并回答:
(1)在溶液中,肯定存在的有___________,肯定不存在的离子有__________________。
(2)写出实验②中的离子反应方程式________________________。
(3)不能确定是否存在的离子有__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】等物质的量的X(g)与Y(g)在密闭容器中进行可逆反应:X(g)+Y(g) ![]() 2Z(g)+W(s) ΔH<0,下列叙述正确的是 ( )
2Z(g)+W(s) ΔH<0,下列叙述正确的是 ( )
A. 平衡常数K值越大,X的转化率越大
B. 达到平衡时,反应速率v正(X)=2v逆(Z)
C. 达到平衡后降低温度,正向反应速率减小的倍数大于逆向反应速率减小的倍数
D. 达到平衡后,升高温度或增大压强都有利于该反应平衡向逆反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某科研人员提出HCHO(甲醛)与O2在羟基磷灰石(HAP)表面催化生成H2O的历程,该历程示意图如下(图中只画出了 HAP的部分结构):
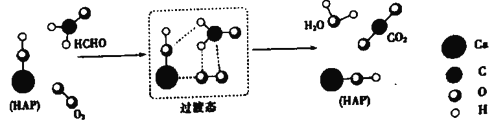
下列说法不正确的是
A. HAP能提高HCHO与O2的反应速率
B. HCHO在反应过程中,有C-H键发生断裂
C. 根据图示信息,CO2分子中的氧原子全部来自O2
D. 该反应可表示为:HCHO+O2![]() CO2+H2O
CO2+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用化学用语表示2Na+2H2O═2NaOH+H2↑中的相关微粒,其中正确的是( )
A.H2O的电子式:![]()
B.中子数为10的氧原子:![]() O
O
C.Na+的结构示意图:![]()
D.NaOH的电离方程式:NaOH═Na++O2﹣+H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中,给一氧化碳和水蒸气的气体混合物加热,在催化剂存在下发生反应:CO(g)+H2O(g)![]() H2(g)+CO2(g)。在500 ℃时,平衡常数K=9。若反应开始时,一氧化碳和水蒸气的浓度都是0.02 mol/L,则在此条件下CO的转化率为( )
H2(g)+CO2(g)。在500 ℃时,平衡常数K=9。若反应开始时,一氧化碳和水蒸气的浓度都是0.02 mol/L,则在此条件下CO的转化率为( )
A. 25% B. 50% C. 75% D. 80%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,三种酸的电离平衡常数如下表所示。
化学式 |
|
|
|
名称 | 醋酸 | 次氯酸 | 亚磷酸 |
电离平衡常数 |
|
|
|
回答下列问题:
(1)pH相等的![]() 溶液、
溶液、![]() 溶液、
溶液、![]() 溶液中,物质的量浓度最小的是____________(填化学式)。
溶液中,物质的量浓度最小的是____________(填化学式)。
(2)已知![]() 为正盐,依据表格数据,
为正盐,依据表格数据,![]() 的第二级电离平衡常数表达式
的第二级电离平衡常数表达式![]() ___________;25℃时,5.6mol·L-1
___________;25℃时,5.6mol·L-1![]() 溶液的pH=____________。
溶液的pH=____________。
(3)向体积均为10mL、![]() 均为
均为![]() mol·L-1的
mol·L-1的![]() 溶液和一元酸
溶液和一元酸![]() 溶液中,分别加水稀释至1000mL,稀释过程中
溶液中,分别加水稀释至1000mL,稀释过程中![]() 的变化如图所示,则HX的电离平衡常数____________(填“大于”“小于”或“等于”)
的变化如图所示,则HX的电离平衡常数____________(填“大于”“小于”或“等于”)![]() 的电离平衡常数,理由是______________________________。
的电离平衡常数,理由是______________________________。
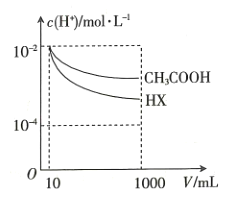
(4)常温下,将0.05mol·L-1的氨水逐滴加入10mL0.1mol·L-1![]() 溶液中至溶液显中性,此时溶液中各离子浓度大小关系为_________________。
溶液中至溶液显中性,此时溶液中各离子浓度大小关系为_________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com