
一定条件下,在某密闭容器中进行如下反应:mA(g)+nB(g) pC(g)+qD(g),若增大压强或升高温度,重新达到平衡,反应速率随时间的变化过程如图所示,则对该反应的叙述正确的是
pC(g)+qD(g),若增大压强或升高温度,重新达到平衡,反应速率随时间的变化过程如图所示,则对该反应的叙述正确的是
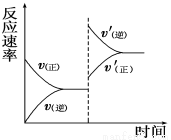
A.正反应是吸热反应 B.逆反应是放热反应
C.m+n<p+q D.m+n>p+q
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:2014-2015学年福建省厦门市高三质量检查理综化学试卷(解析版) 题型:填空题
选考〔化学—物质结构与性质](13分)
钢铁分析中常用过硫酸盐氧化法测定钢中锰的含量,
反应原理为: 2Mn2++5S2O82-+8H2O 2MnO4-+10SO42-+16H+
2MnO4-+10SO42-+16H+
(1)基态锰原子的核外电子排布式为 _
(2)上述反应涉及的元素属于同主族元素,其第一电离能由大到小的顺序为 (填元素符号)。
(3)已知H2.S2O8的结构如图。
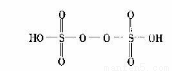
①H2.S2O8硫原子的轨道杂化方式为 。
②上述反应中被还原的元素为 。
③上述反应每生成1 mol MnO4 -,S2O82- 断裂的共价键类型及其数目为 。
(4)一定条件下,水分子间可通过O一H...O氢键将从H2O分子结合成三维骨架结构,其中的多面体孔穴中可包容气体小分子,形成笼形水合包合物晶体
①下图是一种由水分子构成的正十二面体骨架(“o”表示水分子),其包含的氢键数为 ;
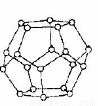
②实验测得冰中氢键的作用能为18.8目kJ·mol-1,而冰的熔化热为5.0kJ·mol-1,其原因可能是 。
查看答案和解析>>
科目:高中化学 来源:2014-2015广东省深圳市南山区上学期高一化学期末试卷(解析版) 题型:选择题
下列叙述Ⅰ、Ⅱ正确且有因果关系的是
选项 | 陈述Ⅰ | 陈述Ⅱ |
A | 金属钠具有强还原性 | 金属钠可制作高压钠灯 |
B | Al2O3熔点高 | Al2O3可用作耐火材料 |
C | 明矾溶于水生成Al(OH)3胶体 | 明矾可作净水剂 |
D | Fe2O3是碱性氧化物 | Fe2O3可作红色油漆和涂料 |
查看答案和解析>>
科目:高中化学 来源:2014-2015广东省汕头市等三校高二上学期期末化学试卷(解析版) 题型:填空题
(14分)二甲醚(CH3OCH3)是一种重要的清洁燃料,也可替代氟利昂作制冷剂等,对臭氧层无破坏作用。工业上以CO和H2为原料生产二甲醚CH3OCH3的新工艺主要发生三个反应:
①CO(g) + 2H2(g) CH3OH(g) △H1=-Q1 kJ·mol-1
CH3OH(g) △H1=-Q1 kJ·mol-1
② 2CH3OH(g) CH3OCH3(g)+ H2O(g) △H2=-Q2 kJ·mol-1
CH3OCH3(g)+ H2O(g) △H2=-Q2 kJ·mol-1
③ CO(g)+ H2O(g) CO2(g) + H2(g) △H3=-Q3 kJ·mol-1
CO2(g) + H2(g) △H3=-Q3 kJ·mol-1
回答下列问题:
(1)新工艺的总反应3H2(g)+ 3CO(g) CH3OCH3(g)+ CO2(g)的热化学方程式为_________。
CH3OCH3(g)+ CO2(g)的热化学方程式为_________。
(2)工业上一般在恒容密闭容器中采用下列反应合成甲醇:CO(g) + 2H2(g) CH3OH (g) △H
CH3OH (g) △H
下表所列数据是该反应在不同温度下的化学平衡常数(Κ)。
温度 | 250℃ | 300℃ | 350℃ |
K | 2.041 | 0.270 | 0.012 |
①由表中数据判断ΔH 0 (填“>”、“=”或“<”)。能够说明某温度下该反应是平衡状态的是
A.体系的压强不变 B.密度不变
C.混合气体的相对分子质量不变 D.c(CO)=c(CH3OH)
②某温度下,将 2mol CO和 6mol H2 充入2L的密闭容器中,充分反应 10min后,达到平衡时测得c(CO)=0.2mol/L,计算此温度下的平衡常数K= 。
(3)工业生产是把水煤气中的混合气体经过处理后获得的较纯H2用于合成氨。合成氨反应原理为:N2(g)+3H2(g)  2NH3(g) ΔH=-92.4kJmol-1。实验室模拟化工生产,在恒容密闭容器中冲入一定量N2和H2后,分别在不同实验条件下反应,N2浓度随时间变化如图。请回答下列问题:
2NH3(g) ΔH=-92.4kJmol-1。实验室模拟化工生产,在恒容密闭容器中冲入一定量N2和H2后,分别在不同实验条件下反应,N2浓度随时间变化如图。请回答下列问题:
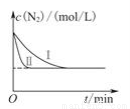
①与实验Ⅰ比较,实验Ⅱ改变的条件为 。
②在实验Ⅲ中改变条件为采用比实验Ⅰ更高的温度,请在下图中画出实验I和实验Ⅲ中NH3浓度随时间变化的示意图。
查看答案和解析>>
科目:高中化学 来源:2014-2015广东省汕头市等三校高二上学期期末化学试卷(解析版) 题型:选择题
有A、B、C、D四种金属,将A与B用导线联结起来,浸入电解质溶液中,B不易被腐蚀;将A、D分别投入到等浓度的盐酸中,D比A反应剧烈;将铜浸入B的盐溶液中无明显变化;将铜浸入C的盐溶液中,有金属C析出。据此可推知它们的金属活动性由强到弱的顺序为
A.D>C>A>B B.D>A>B>C C.D>B>A>C D.B>A>D>C
查看答案和解析>>
科目:高中化学 来源:2014-2015广东省揭阳市高一上学期期末考试化学试卷(解析版) 题型:实验题
(13分)某兴趣小组设计出如图所示装置来改进教材中“铜与硝酸反应”实验,以探究化学实验的绿色化。
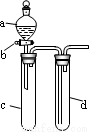
(1)实验前,关闭活塞b,试管d中加水至浸没长导管口,塞紧试管c和d的胶塞,加热c,其目的是___________ _____。
(2)在d中加适量NaOH溶液,c中放一小块铜片,由分液漏斗a向c中加入2 mL浓硝酸,c中反应的化学方程式是 _____________________。
(3)下表是制取硝酸铜的三种方案,能体现绿色化学理念的最佳方案是____ __。
方案 | 反应物 |
甲 | Cu、浓HNO3 |
乙 | Cu、稀HNO3 |
丙 | Cu、O2、稀HNO3 |
(4)该小组还用上述装置进行实验证明酸性:HCl>H2CO3>H2SiO3,则分液漏斗a中加入的试剂是___________,c中加入的试剂是_________,d中加入的试剂是_________;实验现象为___________________ 。
但此实验存在不足之处,改进的措施是___________________________ 。
查看答案和解析>>
科目:高中化学 来源:2014-2015广东省揭阳市高一上学期期末考试化学试卷(解析版) 题型:选择题
化学知识可以帮助理解和解决日常生活中遇到的许多问题,下列说法错误的是
A.胃酸过多的病人,可以服用氢氧化钠来中和胃酸
B.晶体硅是在通信工程中制作光导纤维的主要原料
C.常温下干燥的Cl2能用钢瓶贮存
D.二氧化硅与氢氟酸的反应原理可用来雕刻玻璃
查看答案和解析>>
科目:高中化学 来源:2014-2015广东省揭阳市高二上学期期末考试化学文试卷(解析版) 题型:?????
下列有关乙烯的说法正确的是
A.溴水中通入乙烯气体后,颜色会褪去
B.一定条件下,乙烯可与氢气发生加成反应
C.乙烯可使酸性高锰酸钾溶液褪色
D.乙烯可燃,完全燃烧后产生CO2和水
查看答案和解析>>
科目:高中化学 来源:2014-2015广东省揭阳市高二上学期期末考试化学文试卷(解析版) 题型:?????
在下列溶液中通入CO2,加热蒸干后不能观察到固体物质的是
A.Ca(OH)2溶液 B.氨水 C.Na2CO3溶液 D.KCl溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com