
下列涉及离子方程式书写的评价合理的是 ( )。
| 选项 | 化学反应及离子方 | 评价 |
| A | 次氯酸钙溶液中通入足量SO2:Ca2++ClO- | 正确 |
| B | 实验室用浓盐酸与MnO2反应制Cl2:MnO2+4H++2Cl- | 错误,H+、Cl-的化学计量数应相等 |
| C | 硝酸铁溶液中加过量氨水:Fe3++3NH3·H2O===Fe(OH)3(胶体)+3NH4+ | 错误,Fe(OH)3应该是沉淀 |
| D | 铝溶于碳酸中:2Al+3H2CO3===2Al3++3H2↑+3CO32- | 正确 |
 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案科目:高中化学 来源: 题型:
用如图装置电解制备N2O5,下列有关说法正确的是 ( )
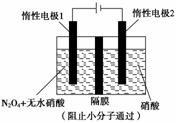
A.N2O5在惰性电极2处产生
B.在惰性电极2处有氢气产生
C.在惰性电极1处发生还原反应
D.在惰性电极2处有NO产生
查看答案和解析>>
科目:高中化学 来源: 题型:
下列反应所得溶液中一定只含一种溶质的是
A.向AlCl3溶液中滴入NaOH溶液 B.向NaOH溶液中通入SO2气体
C.向稀硝酸中加入过量铁粉 D.向Na2CO3溶液中滴入盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
已知:25 ℃时,Ksp[Mg(OH)2]=5.61×10-12,Ksp(MgF2)=7.42×10-11。下列说法正确的是( )。
A.25 ℃时,饱和Mg(OH)2溶液与饱和MgF2溶液相比,前者的c(Mg2+)大
B.25 ℃时,在Mg(OH)2的悬浊液加入少量的NH4Cl固体,c(Mg2+)增大
C.25 ℃时,Mg(OH)2固体在20 mL 0.01 mol·L-1氨水中的Ksp比在20 mL 0.01 mol·L-1NH4Cl溶液中的Ksp小
D.25 ℃时,在Mg(OH)2的悬浊液中加入NaF溶液后,Mg(OH)2不可能转化成为MgF2
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述正确的是( )
①硝酸钾溶液能导电,所以硝酸钾溶液是电解质
②固态氯化钾不导电,但氯化钾是电解质
③氯化氢溶液能导电,所以氯化氢是电解质
④SO2溶于水能导电,所以SO2是电解质
⑤铁导电,所以铁是电解质
⑥H2不导电,所以H2是非电解质
A.①④ B.②③
C.①②③④ D.④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
某无色溶液中含有K+、Cl-、OH-、SO32-、SO42-,为检验溶液中所含的各种阴离子,限用的试剂有:盐酸、硝酸、硝酸银溶液、硝酸钡溶液和溴水。检验其中OH-的实验方法从略,检验其他阴离子的过程如下图所示。

(1)图中试剂①~⑤溶质的化学式分别是:
①__________,②__________,③__________,④__________
⑤_____ _____。
_____。
(2)图中现象a、b、c表明检验出的离子分别是:
a__________、b__________、c__________。
(3)白色沉淀A加试剂②反应的离子方程式是____________________________
__________________。
(4)无色溶液C加试剂③的主要目的是_________________________________
______________________________。
(5)白色沉淀A若加试剂③而不加试剂②,对实验的影响是___________________________________________
 ________。
________。
(6)气体E通入试剂④发生反应的离子方程式是__________________________
____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
有一种新合成的烃称为立方烷,它的碳架结构如图所示,关于它的说法不正确的是( )
 A.它的分子式是C8H8 B.与苯乙烯
A.它的分子式是C8H8 B.与苯乙烯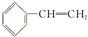 互为同分异构体
互为同分异构体
C.它不能发生加成反应 D.它的二氯取代物共有4种
查看答案和解析>>
科目:高中化学 来源: 题型:
短周期金属元素甲~戊在元素周期表的相对位置如表所示。下列判断正确的是
A.氢氧化物碱性:丙>丁>戊
| 甲 | 乙 | |
| 丙 | 丁 | 戊 |
B.金属性:甲>丙
C.原子半径:丙<丁<戊
D.最外层电子数:甲>乙
查看答案和解析>>
科目:高中化学 来源: 题型:
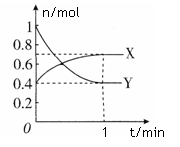
在一定温度下,体积为2 L的密闭容器中,NO2和N2O4之间发生反应:2NO2 (g) (红棕色) N2O4(g) (无色),如图所示。
N2O4(g) (无色),如图所示。
(1)曲线 (填“X”或“Y”)表示NO2的物质的量随时间的变化曲线。
(2)若升高温度,则v(正) ,v(逆) 。(填“加快”或“减慢”)。
(3)若上述反应在甲、乙两个相同容器内同时进行,分别测得甲中v(NO2)=18 mol/(L·min),乙中v(N2O4)=0.2 mol/(L·s),则 中反应更快。
(4)在0到1 min中内用X表示该反应的速率是 ,该反应达限度时,Y的转化率 ,反应开始时与反应达平衡状态时的压强之比为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com