
| A. | CO2通入水中 | B. | SO3通入水中 | ||
| C. | 钠粒投入水中 | D. | 硫酸铜溶液中滴加氨水 |
科目:高中化学 来源: 题型:选择题
| A. | 二氧化硫溶于水能导电,故二氧化硫属于电解质 | |
| B. | 硫酸钡难溶于水,故硫酸钡属于弱电解质 | |
| C. | 硫酸是强电解质,故纯硫酸能导电 | |
| D. | 氢氧根离子浓度相同的氢氧化钠溶液和氨水导电能力相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 下列生活用品主要由有机合成材料制成:羊毛衫、腈纶运动衣、涤纶连衣裙、纯棉T恤 | |
| B. | 不锈钢制作就是在普通钢中添加铬、镍等元素改变了钢铁内部结构,所以不锈钢是化合物 | |
| C. | 黄河入海口沙洲的形成与用卤水点豆腐,都体现了胶体聚沉的性质 | |
| D. | 建筑业使用大量的沙,常使用内陆河的河沙及海洋的海沙 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HCl(澄清石灰水) | B. | NO2(H2O) | C. | SO2(H2O2溶液) | D. | Cl2(NaOH溶液) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,22.4L氮气所含原子数目大于2NA | |
| B. | 1 mol Na2O2跟H2O反应转移的电子数目为2NA | |
| C. | 标准状态下,22.4L三氧化硫所含分子数目大于NA | |
| D. | 1 mol甲烷的质量与0.5 mol O2的质量不相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | MgCl2 | B. | FeSO4 | C. | Na2SO3 | D. | ZnSO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 0.01mol•L-1的溶液 | X | Y | Z | W |
| pH | 12 | 2 | 8.5 | 4.5 |
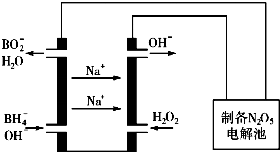
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com