
| 物质 | Fe(OH)2 | Cu(OH)2 | Fe(OH)3 |
| Ksp/25℃ | 8.0×10-16 | 2.2×10-20 | 4.0×10-38 |
| 完全沉淀时的pH范围 | ≥9.6 | ≥6.4 | 3~4 |
| A. | 向该混合溶液中逐滴加入NaOH溶液,最先看到红褐色沉淀 | |
| B. | 向该混合溶液中逐滴加入NaOH溶液,最先看到白色沉淀 | |
| C. | 向该混合溶液中加入适量H2O2,并调节pH到3~4后过滤可获得纯净的CuSO4溶液 | |
| D. | 在pH=5的溶液中Fe3+不能大量存在 |
分析 A、依据图表分析,铁离子首先开始沉淀;
B、依据图表分析,铁离子首先开始沉淀;
C、混合溶液中加入适量H2O2,亚铁离子被氧化为亚铁离子,调节溶液PH=3~4铁离子沉淀完全;
D、由图表可知Fe3+在PH=3~4已经完全沉淀;
解答 解:A、依据阳离子沉淀的PH可知加入氢氧化钠溶液先沉淀的是氢氧化铁,最先看到的是红褐色沉淀,故A正确;
B、依据阳离子沉淀的PH可知加入氢氧化钠溶液先沉淀的是氢氧化铁,最先看到的是红褐色沉淀,故B错误;
C、混合溶液中加入适量H2O2,亚铁离子被氧化为亚铁离子,调节溶液PH=3~4铁离子沉淀完全,最后溶液中的溶质只有CuSO4溶液,所以过滤可获得纯净的CuSO4溶液,故C正确;
D、由图表可知Fe3+在PH=3~4已经完全沉淀,所以PH=5的溶液中Fe3+不能大量存在,故D正确;
故选B.
点评 本题考查了离子沉淀条件的分析判断,盐类水解的应用,除杂实验方法的应用,题目难度中等,侧重于考查学生的分析能力和对基础知识的应用能力.


科目:高中化学 来源: 题型:选择题
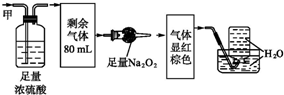
| A. | NH320ml、NO240ml、N240ml | B. | NH3 20ml、NO32ml、CO248ml | ||
| C. | NH320ml、NO20ml、CO260ml | D. | NH320ml、CO228ml、NO52ml |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 纯碱溶液能清洗油污:CO32-+2H2O═H2CO3+2OH- | |
| B. | 铜与浓硫酸共热产生气体:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+H2↑ | |
| C. | 铁钉在潮湿的空气中很快被腐蚀:Fe-3e-═Fe3+ | |
| D. | 氨气遇到氯化氢时产生白烟:NH3+HCl═NH4Cl |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 50mL盐酸 | 50mL盐酸 | 50mL盐酸 | |
| m(混合物) | 9.2g | 15.7g | 27.6g |
| V(CO2)(标况) | 2.24L | 3.36L | 3.36L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
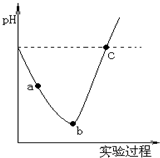 在常温下,取一定量的蒸馏水,然后将Cl2缓慢通入水中至饱和,再向所得饱和氯水中滴加0.1mol/L的NaOH溶液.整个实验进程中溶液的pH变化曲线如图所示,下列叙述正确的是( )
在常温下,取一定量的蒸馏水,然后将Cl2缓慢通入水中至饱和,再向所得饱和氯水中滴加0.1mol/L的NaOH溶液.整个实验进程中溶液的pH变化曲线如图所示,下列叙述正确的是( )| A. | 实验进程中可用pH试纸测定溶液的pH | |
| B. | 向a点所示溶液中能入SO2,溶液的酸性和漂白性均增强 | |
| C. | 由a点到b点的过程中,溶液中c(H+)/c(ClO-)减小 | |
| D. | c点所示的溶液中,c(Na+)=c(ClO-)+c(Cl-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 物质的量浓度相同的硫酸氢铵溶液和醋酸铵溶液中,硫酸氢铵中的铵根离子物质的量浓度较小 | |
| B. | 在10mL 0.1 mol/L的AgNO3溶液中加入6mL等浓度的NaCl溶液,有白色沉淀产生,再加入6 mL等浓度的Na2S溶液,溶液中又有黑色沉淀生成,说明Ksp(Ag2S)<Ksp(AgCl) | |
| C. | 物质的量浓度均为0.02 mol/L的弱酸HX及其盐NaX等体积混合后:c(X-)+c(HX)=0.02 mol/L | |
| D. | 己知Ksp(AgCl)=1.56×10-10,Ksp(Ag2CrO4)=9.0×10-12.在含C1-、CrO42-浓度相同的溶液中滴加AgNO3溶液时,首先生成Ag2CrO4沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1000mL,106g | B. | 1000mL,286g | C. | 950mL,100.7g | D. | 950mL,271.7g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化学反应速率是化学反应进行快慢程度的物理量 | |
| B. | 化学反应速率通常用单位时间内生成或消耗某物质的质量的多少来表示 | |
| C. | 在同一个反应中,可以用反应物或生成物来表示反应速率 | |
| D. | 化学反应速率的常用单位有mol/(L•s)和mol/(L•min) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com