
| A.每一周期元素都是从碱金属开始,以稀有气体结束 |
| B.f区都是副族元素,s区和p区的都是主族元素 |
| C.已知在20℃1molNa失去1mol电子需吸收650kJ能量,则其第一电离能为650KJ/mol |
| D.Ge的电负性为1.8,则其是典型的非金属 |
 赢在课堂名师课时计划系列答案
赢在课堂名师课时计划系列答案 天天向上课时同步训练系列答案
天天向上课时同步训练系列答案 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案科目:高中化学 来源:不详 题型:单选题
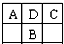
| A.A的氧化物有多种形式 |
| B.B最高价氧化物对应的水化物是一种弱酸 |
| C.C的氢化物比HCl稳定 |
| D.D元素形成的单质不止一种 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.反应中,X原子得到的电子数比Y原子得到的电子数多 |
| B.最高正价,X比Y的高 |
| C.气态氢化物溶于水后的酸性,X的强于Y |
| D.X单质能与Y的氢化物反应生成Y单质 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.微粒半径:K+>Na+>Al3+>Cl- |
| B.氢化物的稳定性:HCl>H2S>PH3>SiH4 |
| C.酸性:H2SO4>H3PO4>H2CO3>HClO |
| D.金属性:Be<Mg<Ca<K |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
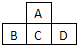
| A元素的核外电子数和电子层数相等,也是宇宙中最丰富的元素 |
| B元素原子的核外p电子数比s电子数少1 |
| C原子的第一至第四电离能分别是: I1=738kJ/molI2=1451kJ/molI3=7733kJ/molI4=10540kJ/mol |
| D原子核外所有p轨道全满或半满 |
| E元素的主族序数与周期数的差为4 |
| F是前四周期中电负性最小的元素 |
| G在周期表的第七列 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
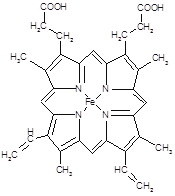
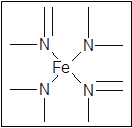
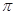 键有___________mol。
键有___________mol。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com