
【题目】早期发现的一种天然二十面体准晶颗粒由Cu、Fe、Al三种金属元素组成,回答下列问题:
(1)准晶是一种无平移周期序,但有严格准周期位置序的独特晶体,可通过_________方法区分晶体、准晶体和非晶体。
(2)基态Cu原子最高能层符号_________,Cu位于周期表________区;新制备的Cu(OH)2可将丙醛(CH3CH2CHO)氧化成丙酸,而自身还原成Cu2O,Cu2O中Cu元素的化合价为_________。1mol丙醛分子中含有的σ键的数目为_________,丙酸的沸点明显高于丙醛,其主要原因是_________________。
(3)已知:
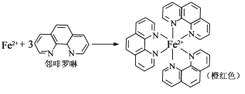
①Fe2+与邻啡罗啉形成的配合物(形成过程如图)中,配位体为_________________,配位原子数为__。
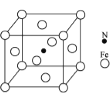
②铁能与氮形成一种磁性材料,其晶胞结构如图,则该磁性材料的化学式为___________。
③尿素(H2NCONH2)可用于制有机铁肥,主要代表有[Fe(H2NCONH2)6](NO3)3[三硝酸六尿素合铁(Ⅲ)]。尿素分子中C、N原子的杂化方式分别是________、_________;与NO3-互为等电子体的一种化合物是_________(写化学式)。
(4)Al单质为面心立方晶体,其晶胞参数a=0.405nm,晶胞中铝原子的配位数为______,列式表示Al单质的密度_________________gcm﹣3(不必计算出结果)。
【答案】X射线衍射 N ds +1 9NA 乙酸存在分子间氢键 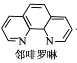 6 Fe4N sp2 sp3 SO3 12
6 Fe4N sp2 sp3 SO3 12 ![]()
【解析】
(1)区分晶体、准晶体和非晶体可用X射线衍射法;
(2)根据Cu的核外电子排布判断Cu的能级和在周期表中的位置;1个丙醛分子含有9个σ键,则1mol丙醛含有9molσ键;丙酸分子间可形成氢键,丙醛不能形成氢键,所以丙酸的沸点高于丙醛;
(3)①配位数就是在配位个体中与一个形成体成键的配位原子的总数;
②利用均摊法确定其化学式;
③由尿素的结构式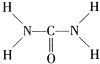 可知,尿素分子中N原子成3个单键,含有1对孤对电子,杂化轨道数为4,C原子成2个C-N键、1个C=O键,没有孤对电子,杂化轨道数目为3,据此判断;原子总数相等,价电子总数相等的微粒为等电子体,利用代换法书写;
可知,尿素分子中N原子成3个单键,含有1对孤对电子,杂化轨道数为4,C原子成2个C-N键、1个C=O键,没有孤对电子,杂化轨道数目为3,据此判断;原子总数相等,价电子总数相等的微粒为等电子体,利用代换法书写;
(4)根据密度=质量/体积进行计算。
(1)从外观无法区分三者,但用X光照射挥发现:晶体对X射线发生衍射,非晶体不发生衍射,准晶体介于二者之间,因此通过有无衍射现象即可确定,故答案为:X射线衍射。
(2)Cu原子核外电子数为29,基态原子核外电子排布为1s22s22p63s23p63d104s1,电子占据的最高能层符号为N;Cu在周期表位于第四周期第IB,所以属于ds区;Cu2O中O元素的化合价为-2价,根据化合物的化合价代数和为0可知:Cu元素的化合价为+1价;1个丙醛分子含有9个σ键和一个π键,则1mol丙醛含有9molσ键,即9NA个σ键;丙酸分子间可形成氢键,丙醛不能形成氢键,所以丙酸的沸点高于丙醛;故答案为:N,ds,+1,9NA,丙酸存在分子间氢键。
(3)①配位数就是在配位个体中与一个形成体成键的配位原子的总数,所以Fe2+与邻啡罗啉形成的配合物(形成过程如图)中,配位体为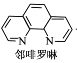 ,配位数为6,故答案为:
,配位数为6,故答案为: ,6。
,6。
②铁原子个数=8×![]() +6×
+6×![]() =4,氮原子个数是1,所以其化学式为Fe4N,故答案为:Fe4N。
=4,氮原子个数是1,所以其化学式为Fe4N,故答案为:Fe4N。
③由尿素分子的结构式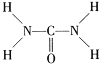 可知,尿素分子中C原子成2个C-N键、1个C=O键,没有孤对电子,杂化轨道数目为3,C原子采取sp2杂化,N原子成3个单键,含有1对孤对电子,杂化轨道数为4,N原子采取sp3杂化;N原子最外层电子数为5,将N原子及1个单位负电荷,可以替换为S原子,故SO3与NO3-互为等电子体故答案为:sp2,sp3,SO3。
可知,尿素分子中C原子成2个C-N键、1个C=O键,没有孤对电子,杂化轨道数目为3,C原子采取sp2杂化,N原子成3个单键,含有1对孤对电子,杂化轨道数为4,N原子采取sp3杂化;N原子最外层电子数为5,将N原子及1个单位负电荷,可以替换为S原子,故SO3与NO3-互为等电子体故答案为:sp2,sp3,SO3。
(4)在Al晶体的一个晶胞中与它距离相等且最近的Al原子在通过这个顶点的三个面心上,面心占1/2,通过一个顶点可形成8个晶胞,因此该晶胞中铝原子的配位数为8×3×![]() =12;一个晶胞中Al原子数为8×
=12;一个晶胞中Al原子数为8×![]() +6×
+6×![]() =4,因此Al的密度ρ=m/V=
=4,因此Al的密度ρ=m/V=![]() gcm﹣3,故答案为:12,
gcm﹣3,故答案为:12,![]() 。
。


科目:高中化学 来源: 题型:
【题目】下列说法正确的是 ( )
A.用干燥的pH试纸测定氯水的pH
B.配制一定浓度的NaOH溶液,定容时仰视读数,使配制的溶液浓度偏小
C.用加热分解的方法可将NH4Cl固体和Ca(OH)2固体的混合物分离
D.将25.0 g CuSO4·5H2O溶于100 mL蒸馏水中,配制100 mL 1.0 mol/L CuSO4溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实与浓硫酸表现出的性质(括号中)对应关系正确的是( )
A. 在空气中敞口久置的浓硫酸,溶液质量增大![]() 难挥发性
难挥发性![]()
B. 在加热条件下铜与浓硫酸反应![]() 强氧化性、酸性
强氧化性、酸性![]()
C. 蔗糖与浓硫酸反应中有海绵状的炭生成![]() 吸水性
吸水性![]()
D. 浓硫酸与少量胆矾晶体混合,晶体由蓝色变成白色![]() 脱水性
脱水性![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在BaSO4饱和溶液中,加入Na2SO4(s),达到溶解平衡时,下列关系式正确的是( )
A. c(Ba2+)=c(SO42-)
B. c(Ba2+)≠c(SO42-),c(Ba2+)·c(SO42-)=Ksp(BaSO4)
C. c(Ba2+)=c(SO42-)=[Ksp(BaSO4)]1/2
D. c(Ba2+)≠c(SO42-),c(Ba2+)·c(SO42-)≠Ksp(BaSO4)
查看答案和解析>>
科目:高中化学 来源: 题型:
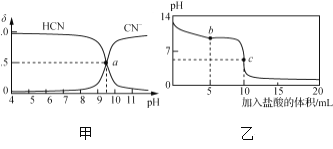
【题目】25 ℃时,NaCN溶液中CN-、HCN浓度所占分数(δ)随pH变化的关系如下图甲所示。向10 mL 0.01 mol·L-1 NaCN溶液中逐滴加入0.01 mol·L-1的盐酸,其pH变化曲线如下图乙所示。
下列溶液中微粒的物质的量浓度关系一定正确的是( )
A. 图甲中pH=7的溶液:c(Cl-)=c(HCN)
B. 图甲中a点的溶液:c(CN-)<c(Cl-)
C. 图乙中b点的溶液:c(CN-)>c(Cl-)>c(HCN)>c(OH-)>c(H+)
D. 图乙中c点的溶液:c(Na+)+c(H+)=c(HCN)+c(OH-)+2c(CN-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学研究性学习小组为了解从工业溴中提纯溴的方法,查阅了有关资料,Br2的沸点为59℃,微溶于水,有毒性和强腐蚀性。他们参观生产过程后,设计了如下装置简图:
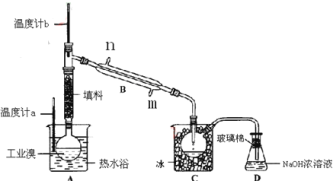
(1)装置B直形冷凝管进水方向______(填“Ⅱ”或“Ⅲ”),装置D的名称是_________。
(2)在A圆底烧瓶中加入一定量工业溴和2小片碎瓷片,加入碎瓷片的作用是_________;如果加热一段时间后发现忘记加碎瓷片,应该采取的正确操作是_______(填正确答案标号)。A.立即补加 B.冷却后补加 C.不需补加 D.重新配料
(3)整套实验装置中仪器连接均不能用橡胶塞和橡胶管,其原因是_____________________。
(4)实验装置气密性良好,要达到提纯溴的目的,操作中如何控制关键条件:___________。
(5)装置C的作用:_____________________。装置D的作用是________________________。
(6)提纯液溴也要用到分液操作,分液漏斗在使用前须清洗干净并___________;用CCl4提取溴时,产物应该从分液漏斗的______________(填“上口倒出”或“下口放出”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】加碘盐中含有KIO3,其能发生反应KIO3+5KI+3H2SO4=3I2+3K2SO4+3H2O,下列有关该反应的说法正确的是( )
A.H2SO4是氧化剂
B.KIO3发生还原反应
C.I2的还原性大于I-
D.每生成0.6molI2,反应转移电子数为1mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚氯酸钠(NaClO2)是一种强氧化性漂白剂,受热易分解。亚氯酸钠制备及部分性质实验如图:
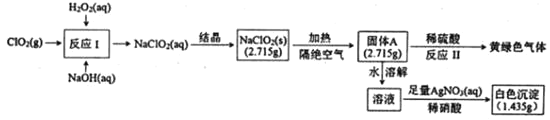
已知:①固体A为两种含氯盐组成的混合物:②AgClO3和AgcClO4都溶于水。
请回答:
(1)双氧水的电子式为___,固体A的成分是___(用化学式表示)。
(2)反应I的离子方程式为___。
(3)反应Ⅱ的化学方程式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某铁磁粉Fe3O4(可能含有Fe2O3或FeO杂质),为确定其纯度,称取23.28g该样品利用图1装置进行实验探究。
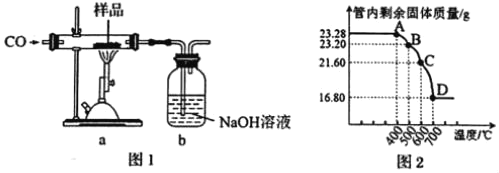
已知:Fe2O3和CO反应是随温度升高而逐步进行的,先生成Fe3O4,再生成FeO(黑色),最后生成Fe。
请回答:
(1)上述实验装置存在一个明显缺陷是___。
(2)利用仪器测定并绘制出反应过程中a装置中玻璃管内的固体质量随温度的变化曲线(图2),样品中含有的杂质成分是___(填化学式)。
(3)上述实验过程中,CO除作为反应物外,还起到的作用是___。
A.实验开始时,排尽装置中的空气,防止加热时发生爆炸
B.防止b中的溶液倒吸入a中
C.停止加热后,继续通CO气体,防止生成物被氧化
D.将产生的CO2全部赶入装置b中,以提高实验的精确度
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com