
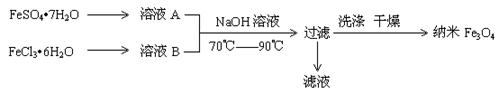
| A.保存溶液A时,应加入少量铁粉 |
| B.其制备反应类型不属于氧化还原反应 |
| C.取滤液进行焰色反应,火焰为黄色 |
| D.FeSO4·7H2O 和 FeCl3·6H2O的物质的量之比最好应为2∶1 |
 全优考典单元检测卷及归类总复习系列答案
全优考典单元检测卷及归类总复习系列答案 品学双优卷系列答案
品学双优卷系列答案 小学期末冲刺100分系列答案
小学期末冲刺100分系列答案科目:高中化学 来源:不详 题型:填空题
 R-Br+H2O ②
R-Br+H2O ②| | 乙醇 | 溴乙烷 | 正丁醇 | 1-溴丁烷 |
| 密度/g·cm-3 | 0.7893 | 1.4604 | 0.8098 | 1.2758 |
| 沸点/℃ | 78.5 | 38.4 | 117.2 | 101.6 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
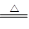 MnCl2 + Cl2↑+ 2H2O。某学习小组利用此原理设计如图所示装置制取氯气并探究其性质。
MnCl2 + Cl2↑+ 2H2O。某学习小组利用此原理设计如图所示装置制取氯气并探究其性质。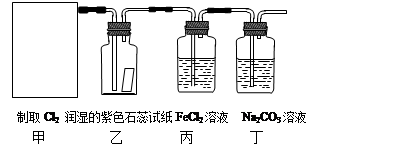
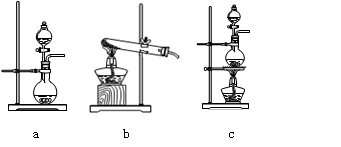
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题
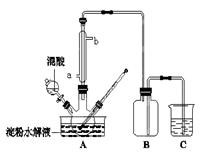

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.观察酸式滴定管液面时,开始俯视,滴定终点平视,所测出的碱液的浓度值 |
| B.用标准盐酸滴定未知浓度的氢氧化钠溶液时,酸式滴定管洗净后,没有用标准盐酸润洗而直接装标准盐酸滴定碱液,所测出的碱液的浓度值 |
| C.用已知浓度的盐酸溶液滴定未知浓度的氢氧化钠溶液用酚酞做指示剂所测出的碱液的浓度值 |
| D.做中和热测定时,在大小两个烧杯之间没有垫碎泡沫塑料(或纸条)所测出的中和热数值 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
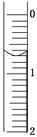
| 滴定次数 实验数据(mL) | 1 | 2 | 3 | 4 |
| V(样品) | 20.00 | 20.00 | 20.00 | 20.00 |
| V(NaOH)(消耗) | 15.95 | 15.00 | 15.05 | 14.95 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
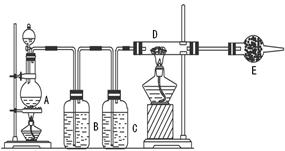
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com