
| 操作步骤 | 实验现象 | 结论 |
| 取一定量的雾霾固体于试管中,加入适量的水溶解,把溶液分成两份. | ||
| 一份加入足量稀盐酸后,再加入BaCl2溶液. | 有白色沉淀生成. | 证明雾霾固体中含有SO42- |
| 另一份加入适量的NaOH浓溶液并加热. | 产生使湿润的红色石蕊试纸变蓝色的气体. | 证明雾霾固体中含有NH4+.综合上面实验,说明雾霾固体颗粒中含有(NH4)2SO4. |
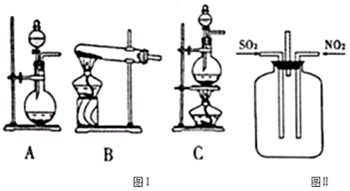
分析 (1)制取二氧化硫可选用浓硫酸和亚硫酸钠在常温下制取,也可用铜和浓硫酸加热制取,由图可知可选用AC装置;
(2)①二氧化硫具有还原性,二氧化氮具有氧化性,两者反应生成三氧化硫和一氧化氮;如果集气瓶中有少量水,则三氧化硫和水反应生成硫酸;
②图Ⅱ装置为二氧化氮和二氧化硫反应的装置,缺少尾气处理,会导致环境污染;
(3)在检验SO42-时,加入氯化钡之前要先加盐酸以排除CO32-离子的干扰.检验铵根离子,通常加入碱液加热,然后用湿润的红色石蕊试纸检验.
解答 解:(1)硫酸的酸性强于亚硫酸,制取二氧化硫可选用浓硫酸和亚硫酸钠在常温下制取,选择仪器A,圆底烧瓶盛放Na2SO3固体,分液漏斗中盛放浓硫酸,滴入烧瓶中发生反应:Na2SO3+H2SO4(浓)═Na2SO4+SO2↑+H2O,也可用浓硫酸与铜在加热条件下制取,选择C,浓硫酸与铜在加热条件下生成硫酸铜、二氧化硫和水,反应的化学方程式为:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O,
故答案为:A(或C );Na2SO3+H2SO4=Na2SO4+SO2↑+H2O[或Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O];
(2)①二氧化硫具有还原性,二氧化氮具有氧化性,实验时往集气瓶中通入等体积的SO2和NO2,观察到集气瓶中有白烟产生,生成三氧化硫,反应方程式为:SO2+NO2=SO3+NO,如果集气瓶中有少量水,则三氧化硫和水反应SO3+H2O=H2SO4,观察不到白烟,
故答案为:SO2+NO2=SO3+NO;生成的SO3与水反应生成硫酸;
②二氧化硫、二氧化氮都为大气污染物,图Ⅱ装置为二氧化氮和二氧化硫反应的装置,缺少尾气处理,所以设计的不合理之处为没有进行尾气处理,会导致环境污染,
故答案为:没有进行尾气处理,会导致环境污染;
(3)在检验SO42-时,加入氯化钡之前要先加盐酸以排除CO32-离子的干扰.即先加盐酸酸化,无现象,再加氯化钡溶液,出现白色沉淀,说明含有SO42-,检验某溶液中含有NH4+的操作方法为:取少量试样加入到试管中,加入氢氧化钠溶液加热,在试管口用湿润的红色石蕊试纸检验放出气体,试纸由红变蓝,
故答案为:
| 操作步骤 | 实验现象 |
| 加入足量稀盐酸后,再加入BaCl2溶液 | |
| 加入适量的NaOH浓溶液并加热 | 产生使湿润的红色石蕊试纸变蓝色的气体 |
点评 本题考查了铜与浓硫酸反应的实验及NO2和SO2的反应实验探究,明确反应原理及产物的性质是解题关键,注意二氧化硫的还原性及酸性氧化物的性质,题目难度中等.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
 25℃时,NH3•H2O的电离平衡常数Kb=1.75×10-5,该温度下,用0.01mol•L-1盐酸滴定10mL a mol•L-1氨水,盐酸的体积V(HCl)与溶液的pH关系如图所示,下列说法正确的是( )
25℃时,NH3•H2O的电离平衡常数Kb=1.75×10-5,该温度下,用0.01mol•L-1盐酸滴定10mL a mol•L-1氨水,盐酸的体积V(HCl)与溶液的pH关系如图所示,下列说法正确的是( )| A. | A点溶液中加少量水,$\frac{c({H}^{+})}{c(N{{H}_{4}}^{+})}$减小 | |
| B. | 原氨水的物质的量浓度约为1.006×10-2mol•L-1 | |
| C. | A、B、C三点溶液中水电离出来的c(OH-):A>B>C | |
| D. | C点时,盐酸和氨水恰好完全反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、I-、K+、Br2 | B. | Mg2+、Cu2+、SO42-、NO3- | ||
| C. | Fe2+、Cl2、K+、SO42- | D. | ClO-、Cl-、CO2、Na+ |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素 | 元素的相关信息 |
| M | 最高价氧化物对应的水化物能与其气态氢化物反应生成盐 |
| N | 原子的M电子层上有3个电子 |
| W | 在短周期元素中,其原子半径最大 |
| X | 其最外层电子数是电子层数的2倍,且低价氧化物能与其气态氢化物反应生成X的单质和H2O |
| Y | 元素最高价正价与最低负价的代数和为6 |
| A. | M的气态氢化物具有还原性,常温下,该氢化物水溶液的pH>7 | |
| B. | W单质在氧气中燃烧后的产物中阴阳离子个数之比为1:2 | |
| C. | 由N和Y所形成的化合物中存在离子键,属于离子化合物 | |
| D. | N、W、X的最高价氧化物对应的水化物两两之间能相互发生反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
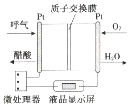
| A. | 电流由呼气所在的铂电极流出 | |
| B. | H+透过质子交换膜流向氧气所在的铂电极 | |
| C. | 电路中流过2mol电子时,消耗11.2LO2 | |
| D. | 该电池的负极反应为:CH3CH2OH+3H2O-12e-═2CO2↑+12H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
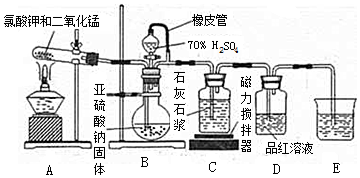
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用热的烧碱溶液除去瓷器表面污垢 | |
| B. | 铝制餐具不宜长时间存放酸性、碱性或咸的物质 | |
| C. | 漂白粉长期放置空气中会被空气中的氧气氧化而变质 | |
| D. | 汽车尾气中含有的氮氧化物,是汽油不完全燃烧造成的 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com