
 提分百分百检测卷系列答案
提分百分百检测卷系列答案 宝贝计划期末冲刺夺100分系列答案
宝贝计划期末冲刺夺100分系列答案 能考试全能100分系列答案
能考试全能100分系列答案科目:高中化学 来源: 题型:选择题
| A. | ②③ | B. | ②④ | C. | ①③ | D. | ①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有①③ | B. | 只有②④ | C. | 只有①②③④ | D. | ①②③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用广泛pH试纸测得氯水的pH=5.2 | |
| B. | 若H2O2分解产生1molO2,理论上转移的电子数约为4×6.02×1023 | |
| C. | 在氧化还原反应中,还原剂得到电子总数等于氧化剂失去电子的总数 | |
| D. | Mg在CO2中燃烧生成MgO和C.在该反应条件下,Mg的还原性强于C的 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
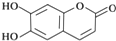
| A. | M的分子式是C9H6O4 | |
| B. | 1molM最多能与2molBr2发生反应 | |
| C. | M与足量的NaOH溶液发生反应时,所得有机产物的化学式为C9H4O5Na4 | |
| D. | 1molM与足量NaHCO3反应能生成2molCO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
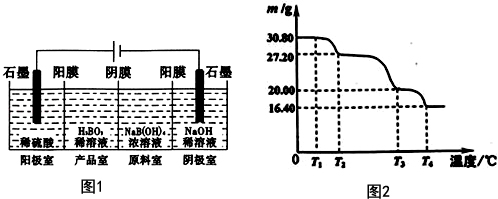 硼酸(H3BO3)与铝酸(H3AlO3)结构相似,可写成B(OH)3.
硼酸(H3BO3)与铝酸(H3AlO3)结构相似,可写成B(OH)3.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com