
【题目】已知X、Y是短周期的两种元素,下列有关比较或说法中一定正确的是( )
选项 | 条件 | 结论 |
A | 若原子半径:X>Y | 原子序数:X<Y |
B | 化合物XnYm中X显负价 | 元素的电负性:X>Y |
C | 若价电子数:X>Y | 最高正价:X>Y |
D | 若X、Y最外层电子数分别为1、7 | X、Y之间一定能形成离子键 |
A.AB.BC.CD.D
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】标准状况下,现有①6.72L CH4②3.01×1023个HCl分子 ③13.6g H2S ④0.2molNH3 , 对这四种气体的氢原子个数由大到小的顺序排列正确的是( )
A.②>③>①>④
B.②>③>④>①
C.①>④>②>③
D.①>③>④>②
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列电离方程式正确的是( )
A. KOH=K++O2-+H+ B. MgCl2=Mg2++Cl-
C. KCl=K++Cl- D. NaHCO3=Na++H++CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积不变的密闭容器中存在如下反应2SO2(g)+O2(g) ![]() 2SO3(g) ΔH<0,某研究小组探究其他条件下不变时,改变某一条件对上述反应的影响,下列分析正确的是
2SO3(g) ΔH<0,某研究小组探究其他条件下不变时,改变某一条件对上述反应的影响,下列分析正确的是
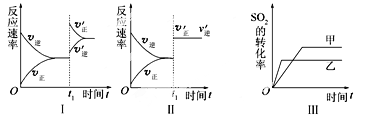
A.图Ⅰ表示的是t1时刻增大O2的浓度对反应速率的影响
B.图Ⅱ表示的是t1时刻加入催化剂后对反应速率的影响
C.图Ⅲ表示的是催化剂对平衡的影响,且甲的催化效率比乙的高
D.图Ⅲ表示的是压强对化学平衡的影响,且乙的压强较高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,回答下列有关问题:
族 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅧA | 0 |
2 | ① | ② | ||||||
3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |
4 | ⑩ |
(1)写出下列元素符号:① , ⑥ , ⑦ .
(2)画出原子的结构示意图:④ , ⑧ .
(3)在上述标出元素中,金属性最强的元素是 , 非金属性最强的元素是_ , 最不活泼的元素是 . (均填元素符号
(4)元素⑦与元素⑧相比,非金属性较强的是(用元素符号表示),下列表述中能证明这一事实的是 . (选填序号) a.常温下⑦的单质和⑧的单质状态不同
b.⑧的氢化物比⑦的氢化物稳定
c.一定条件下⑦和⑧的单质都能与氢氧化钠溶液反应
(5)第三周期中原子半径最大的元素是(填元素符号),跟它同周期原子半径(除稀有气体外)最小的元素是(填元素符号)它们最高价氧化物对应水化物之间反应的离子方程式
(6)已知某元素原子最外层电子数是其次外层电子数的2倍,足量该元素的常见氧化物通入③的最高价氧化物的水化物的溶液中,写出化学方程式: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D 4种元素的核电荷数依次增大,它们的离子的电子层数相同且最外层电子数均为8.A原子的L层电子数与K、M层电子数之和相等,D原子的K、L层电子数之和等于电子总数的一半.请回答下列问题:
(1)4种元素的符号依次是A , B , C , D . 它们的原子半径由大到小的顺序是 .
(2)试写出4种元素的离子结构示意图:A , B , C , D . 它们离子的半径由大到小的顺序 .
(3)它们最高价氧化物对应水化物的化学式分别是 , 分别比较它们酸性和碱性的强弱 .
(4)写出能够生成的气态氢化物的化学式: , 比较其稳定性: , 理由是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,硝酸既表现酸性,又表现氧化性的是
A. Fe2O3跟稀硝酸反应 B. Fe(OH)2跟稀硝酸反应
C. CuO跟稀硝酸反应 D. Al(OH)3跟稀硝酸反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工厂使用石油热裂解的副产物甲烷来制取氢气,其生产流程如下图:

(1)此流程的第II步反应为:CO(g)+H2O(g) ![]() H2(g)+CO2(g),该反应的平衡常数随温度的变化如下表:
H2(g)+CO2(g),该反应的平衡常数随温度的变化如下表:
温度/℃ | 400 | 500 | 830 |
平衡常数K | 10 | 9 | 1 |
从上表可以推断:此反应是 (填“吸”或“放”)热反应。在830℃下,若开始时向恒容密闭容器中充入1mo1CO和2mo1H2O,则达到平衡后CO的转化率为 。
(2)在500℃,按照下表的物质的量(按照CO、H2O、H2、CO2的顺序)投入恒容密闭容器中进行上述第II步反应,达到平衡后下列关系正确的是 。
实验编号 | 反应物投入量 | 平衡时H2浓度 | 吸收或放出的热量 | 反应物转化率 |
A | 1、1、0、0 | c1 | Q1 | α1 |
B | 0、0、2、2 | c2 | Q2 | α2 |
C | 2、2、0、0 | c3 | Q3 | α3 |
A.2c1= c2 =c3 B.2Q1=Q2=Q3 C.α1 =α2 =α3 D.α1 +α2 =1
(3)在一个绝热等容容器中,不能判断此流程的第II步反应达到平衡的是 。
①v(CO2)正=v(H2O)逆
②混合气体的密度不变
③混合气体的平均相对分子质量不变 ④各组分的物质的量浓度不再改变
⑤体系的温度不再发生变化
(4)下图表示此流程的第II步反应,在t1时刻达到平衡、在t2时刻因改变某个条件使浓度发生变化的情况:图中t2时刻发生改变的条件是 、 (写出两种)。
若t4时刻通过改变容积的方法将压强增大为原先的两倍,在图中t4和t5区间内画出CO、CO2浓度变化曲线,并标明物质(假设各物质状态均保持不变)。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com