
| A、化学反应速率大小的决定因素是反应物的性质 |
| B、所有化学反应,温度升高其反应速率一定增大 |
| C、钢铁腐蚀、熟料老化、食物腐败等都是化学变化,减小这些反应的速率有利于生产、生活及可持续发展 |
| D、硫酸工业、硝酸工业、铁的冶炼等都涉及到化学反应且都会产生污染,减小这些反应的速率有利于降低对环境的污染也有利于国民经济的可持续发展 |


科目:高中化学 来源: 题型:
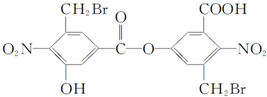
| A、1mol该有机物与足量的NaOH溶液混合共热,充分反应最多可消耗6mol NaOH |
| B、向该有机物溶液中加入FeCl3溶液,振荡后有紫色沉淀产生 |
| C、该有机物能发生消去反应 |
| D、该有机物在稀硫酸中加热水解,有机产物只有一种 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、石油中含有C5-C11的烷烃,可以通过石油的分馏得到汽油 |
| B、含C18以上的烷烃的重油经过催化剂裂化可以得到汽油 |
| C、石油的分馏、煤的干馏都是物理变化 |
| D、煤中含有苯和甲苯,可以用先干馏后分馏的方法把它们分离出来 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 序号 | 氢氧化钡的体积/mL | 盐酸的体积/mL | 溶液的pH |
| ① | 22.00 | 0.00 | 12 |
| ② | 22.00 | 18.00 | 11 |
| ③ | 22.00 | 22.00 | 7 |
查看答案和解析>>
科目:高中化学 来源: 题型:
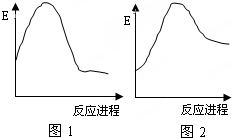
| A、图1可表示C+O2→CO2的能量变化过程 |
| B、图1可表示CaCO3→CaO+CO2的能量变化过程 |
| C、图2可表示Mg+2HCl→MgCl2+H2 的能量变化过程 |
| D、图1表示的反应是吸热反应,图2表示的反应是放热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2Na2O2+2H2O=4NaOH+O2↑ | ||||
| B、Mg3N2+6H2O=3Mg(OH)2↓+2NH3↑ | ||||
| C、Cl2+H2O=HClO+HCl | ||||
D、NH4Cl+NaOH
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1:3:5 |
| B、5:1:3 |
| C、2:4:3 |
| D、3:1:5 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com