
| A. | C | B. | N | C. | Si | D. | Cl |
分析 某元素的最高正价和最低负价的绝对值相等,应位于周期表ⅣA族,对应的氢化物化学式为XH4,气态氢化物中该元素含量为87.5%,可计算相对原子质量,结合原子核内质子数与中子数也相等,可确定元素种类,以此解答该题.
解答 解:某元素的最高正价和最低负价的绝对值相等,应位于周期表ⅣA族,对应的氢化物化学式为XH4,气态氢化物中该元素含量为87.5%,设元素相对原子质量为M,
则$\frac{M}{M+4}$=87.5%M=28,原子核内质子数与中子数也相等,则原子序数为14,应为Si元素.
故选C.
点评 本题考查原子结构与推断,题目难度不大,注意根据氢化物相对分子质量结合原子守恒计算M的相对原子质量为解答该题的关键.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
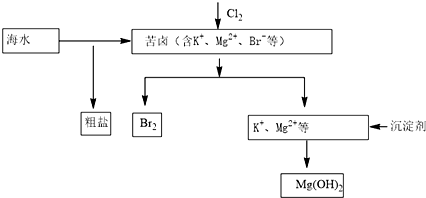
| A. | 工业生产中常选用NaOH作为沉淀剂 | |
| B. | 粗盐可采用溶解、过滤和重结晶等过程进一步提纯 | |
| C. | 向苦卤中通入Cl2是为了提取溴 | |
| D. | 富集溴一般先用空气和水蒸气吹出单质溴,再用SO2将其还原吸收 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验方案 | 观察要点 |
| A | 等浓度的醋酸与氢氧化钠溶液反应 | 恰好反应时的体积比 |
| B | 醋酸溶液中加入醋酸钠固体 | 溶液pH的变化 |
| C | 等体积等浓度的盐酸和醋酸分别和等量镁条反应 | 产生H2的起始速率 |
| D | 将pH=4的醋酸稀释成PH=6的溶液 | 加H2O的量 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2O2是碱性氧化物,SO2是酸性氧化物 | |
| B. | 分别加热用Cl2、SO2和Na2O2漂白过的品红溶液都能恢复红色 | |
| C. | 将Cl2和SO2同时通入水中能生成两种强电解质 | |
| D. | Cl2、SO2和Na2O2漂白原理相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (1)已知反应:H2+Cl2$→_{400℃}^{CuO/CuCl_{2}}$2HCl,已知H-H键能为436kJ/mol,Cl-Cl键能为243kJ/mol,H-Cl键能为432kJ/mol.
(1)已知反应:H2+Cl2$→_{400℃}^{CuO/CuCl_{2}}$2HCl,已知H-H键能为436kJ/mol,Cl-Cl键能为243kJ/mol,H-Cl键能为432kJ/mol.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
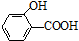 )存在分子内氢键,对羟基苯甲酸 (
)存在分子内氢键,对羟基苯甲酸 ( 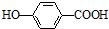 )存在分子间氢键.则两者的熔点、沸点的相对大小关系是( )
)存在分子间氢键.则两者的熔点、沸点的相对大小关系是( )| A. | 前者>后者 | B. | 前者<后者 | C. | 前者=后者 | D. | 无法估计 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com