
铁及铁的化合物应用广泛,如FeCl3可用作催化剂、印刷电路铜板腐蚀剂和外伤止血剂等。
(1)写出FeCl3溶液腐蚀印刷电路铜板的离子方程式 。
(2)若将(1)中的反应设计成原电池,请画出原电池的装置图,标出正极、负极,并写出电极反应。
正极反应 ;
负极反应 。
 开心蛙状元测试卷系列答案
开心蛙状元测试卷系列答案科目:高中化学 来源: 题型:填空题
(10分)(1)为了验证Fe3 +与Cu2+氧化性强弱,下列装置能达到实验目的的是___________
(2)将CH4设计成燃料电池,其利用率更高,装置如图所示(A、B为多孔碳棒)。
①_______处电极入口通甲烷(填A或B),其电极反应式为_______________________________
_________________________________________
②当消耗甲烷的体积为22.4L(标准状况下)时, 假设电池的能量转化率为100%,则导线中转移电子的物质的量为 ,消耗KOH的物质的量为_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
某化学兴趣小组为了探索铝电极在原电池中的作用,设计并进行了以下一系列实验,实验结果记录如下:
| 编号 | 电极材料 | 电解质溶液 | 电流计指针偏转方向 |
| ① | Mg 、Al | 稀盐酸 | 偏向Al |
| ② | Al、Cu | 稀盐酸 | 偏向Cu |
| ③ | Al、石墨 | 稀盐酸 | 偏向石墨 |
| ④ | Mg、Al | NaOH溶液 | 偏向Mg |
| ⑤ | Al、Zn | 浓硝酸 | 偏向Al |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
将1 L含有0.4 mol CuSO4和0.2 mol NaCl 的水溶液用惰性电极电解一段时间后。
(1)若在一个电极上得到0.1 mol Cu,另一电极上析出气体(在标准状况下)的体积是________ L。
(2)若在一个电极上恰好得到0.4 mol Cu,另一电极上再析出气体(在标准状况下)的体积是________ L。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
第三代混合动力车,可以用电动机、内燃机或二者结合推动车轮。汽车上坡或加速时,电动机提供推动力,降低汽油的消耗;在刹车或下坡时,电池处于充电状态。
(1)混合动力车目前一般使用镍氢电池,该电池中镍的化合物为正极,储氢金属(以M表示)为负极,碱液(主要为KOH)为电解质溶液。镍氢电池充放电原理示意如图,其总反应式为:H2+2NiOOH 2Ni(OH)2
2Ni(OH)2
根据所给信息判断,混合动力车上坡或加速时,乙电极周围溶液的pH (填“增大”、“减小”或“不变”),该电极的电极反应式为 。
(2)Cu2O是一种半导体材料,可通过如图的电解装置制取,电解总反应为:2Cu+H2O Cu2O+H2↑
Cu2O+H2↑
阴极的电极反应式是 。
用镍氢电池作为电源进行电解,当蓄电池中有1 mol H2被消耗时,Cu2O的理论产量为 g。
(3)远洋轮船的钢铁船体在海水中易发生电化学腐蚀中的 腐蚀。为防止这种腐蚀,通常把船体与浸在海水里的Zn块相连,或与像铅酸蓄电池这样的直流电源的 (填“正”或“负”)极相连。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
氯碱厂电解饱和食盐水制取NaOH溶液的工艺流程如示意图所示,完成下列填空:
(1)在电解过程中,与电源负极相连的电极上的电极反应式为________________,若检验与电源正极相连的电极上的气体产物,实验室中通常选用的化学试剂是________________________________。
(2)工业食盐含Ca2+、Mg2+等杂质,精制过程发生反应的离子方程式为________________。
(3)如果粗盐中SO42-含量较高,必须添加钡试剂除去SO42-,该钡试剂可以是________。(选填a、b、c)。
a.Ba(OH)2 b.Ba(NO3)2 c.BaCl2
(4)为了有效地除去Ca2+、Mg2+、SO42-,加入试剂的合理顺序为_______(选填a、b、c)。
a.先加NaOH,后加Na2CO3,再加钡试剂
b.先加NaOH,后加钡试剂,再加Na2CO3
c.先加钡试剂,后加NaOH,再加Na2CO3
(5)脱盐工序中利用NaOH和NaCl在溶解度上的差异,通过________、冷却________、(填写操作名称)除去NaCl。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
如图为相互串联的甲、乙两电解池。试回答:
(1)若甲电解池利用电解原理在铁上镀铜,则A是 、 (填电极材料和电极名称),电极反应是 ;B是(要求同A) 、 ,电极反应是 ,应选用的电解质溶液是 ;乙电解池中若滴入少量酚酞试液,开始电解一段时间,铁极附近呈 色。
(2)若甲电解池阴极增重1.28g,乙电解池中剩余溶液仍为400mL,则电解后所得溶液中新生成溶质的物质的量浓度为 mol/L,溶液的pH等于 。
(3)若甲电解池以I=0.21A的电流电解60min后阴极增重0.25g,则此实验测得的阿伏加德罗常数NA为多少(已知电子电量e—=1.60×10—19C)?(简要写计算过程)
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
电解法在金属精炼、保护环境、处理废水中起着十分重要的作用。
(1)如图为电解精炼银的示意图,________(填a或b)极为含有杂质的粗银,若b极有少量红棕色气体生成,则生成该气体的电极反应式为______________________。
AgNO3—HNO3溶液
(2)电解法处理酸性含铬废水(主要含有Cr2O72-)时,以铁板作阴、阳极,处理过程中存在反应Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O,最后Cr3+以Cr(OH)3形式除去。回答下列问题:
①写出电极反应式:阴极________________,阳极________________。
②当生成1 mol Cr(OH)3时,电路中转移电子的物质的量至少为________mol。
③电解过程中有Fe(OH)3沉淀生成,原因是___________________________。
(3)电解降解法可用于治理水中硝酸盐的污染。电解降解NO3-的原理如图所示。
电源正极为________(填A或B),阴极反应式为______________________。
②若电解过程中转移了2 mol电子,则膜两侧电解液的质量变化差(Δm左-Δm右)为________g。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
某小组按图1所示的装置探究铁的吸氧腐蚀。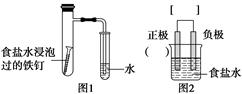
完成下列填空:
(1)图2是图1所示装置的示意图,在图2的小括号内填写正极材料的化学式;在方括号内用箭头表示出电子流动的方向。
(2)写出正、负极反应的方程式。
正极:________________,负极:________________。
(3)按图1装置实验,约8分钟才看到导管中液柱上升,下列措施可以更快更清晰地观察到液柱上升的是____________________(填字母序号)。
a.用纯氧气代替具支试管内的空气
b.用食盐水浸泡过的铁钉再蘸取铁粉和炭粉的混合物
c.用毛细尖嘴管代替玻璃导管,并向试管的水中滴加少量红墨水
(4)升高温度可以加快化学反应速率,建议用酒精灯加热具支试管。这一措施________(填“可行”或“不行”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com