
 ;
;分析 A、B、C、D、E为原子序数依次增大的五种短周期元素,B、C和E在周期表中相邻,且C、E同主族,则B、C处于第二周,E处于第三周期,A和D最外层电子数相同,二者同主族,结合原子序数可知D只能处于第三周期,B、C的最外层电子数之和等于D的原子核外电子数,B、C最外层电子数之和最大为13,D的核外电子数只能为11或13,其中仅含有一种金属元素,且A和C可形成两种常见的液态化合物,则A为H元素、B为N元素、C为O元素、D为Na、E为S元素,据此解答.
解答 解:A、B、C、D、E为原子序数依次增大的五种短周期元素,B、C和E在周期表中相邻,且C、E同主族,则B、C处于第二周,E处于第三周期,A和D最外层电子数相同,二者同主族,结合原子序数可知D只能处于第三周期,B、C的最外层电子数之和等于D的原子核外电子数,B、C最外层电子数之和最大为13,D的核外电子数只能为11或13,其中仅含有一种金属元素,且A和C可形成两种常见的液态化合物,则A为H元素、B为N元素、C为O元素、D为Na、E为S元素.
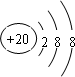
(1)B为N元素,原子结构示意图: ,故答案为:
,故答案为: ;
;
(2)离子的电子层数越多,其离子半径越大,电子层结构相同的离子中,离子半径随着核电荷数的增大而减小,所以离子半径大小顺序是S2->O2->Na+,由A、B、C三种元素按4:2:3组成的化合物为NH4NO3,所含的化学键类型有离子键、共价键,
故答案为:S2->O2->Na+;离子键、共价键;
(3)在100mL 18mol/L的浓H2SO4溶液中加入过量的铜片,加热使之充分反应,铜片部分溶解,随反应进行浓硫酸变为稀硫酸,稀硫酸不与Cu反应,硫酸的物质的量为0.1mol/L×18mol/L=1.8mol,发生反应:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O,假设浓硫酸完全反应,生成二氧化硫为0.9mol,故实际生成二氧化硫的体积小于0.9mol×22.4L/mol=20.16L,
欲使上述反应中剩余的铜片继续溶解,可向其中加入B的最高价含氧酸所形成的钠盐,即进入NaNO3,反应的离子方程式为:3Cu+8H++2NO3-+=3Cu2++2NO↑+4H2O,
故选:ab;3Cu+8H++2NO3-+=3Cu2++2NO↑+4H2O.
点评 本题考查位置结构性质关系及其应用,推断元素是解题关键,侧重考查学生分析推理能力、知识迁移应用能力,难度中等.


科目:高中化学 来源: 题型:选择题
 、
、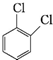
| A. | ①②③⑤④ | B. | ③⑤④①② | C. | ④②①⑤③ | D. | ③④②①⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 ,丁香油酚不应具有的化学性质是( )
,丁香油酚不应具有的化学性质是( )| A. | 可以发生加聚反应 | B. | 可以与强碱溶液反应 | ||
| C. | 与NaHCO3反应放出CO2 | D. | 可与溴水发生加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol稀H2SO4与足量NaOH溶液反应 | |
| B. | 稀醋酸与NaOH溶液反应生成1mol H2O | |
| C. | 稀盐酸与稀Ba(OH)2溶液反应生成1mol H2O | |
| D. | 稀NaOH与95%浓硫酸反应生成1mol H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 族 周期 | IA | IIA | IIIA | IV A | V A | VI A | VII A | O |
| 一 | A | |||||||
| 二 | B | C | ||||||
| 三 | D | E | F | G | H | I | ||
| 四 | K | J | ||||||
 .
.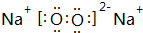 ,它属于离子(离子或共价)化合物.
,它属于离子(离子或共价)化合物.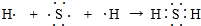 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (部分试剂和反应条件已略去).
(部分试剂和反应条件已略去).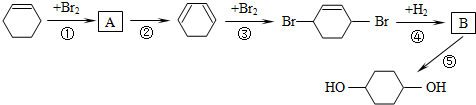
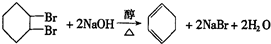
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在甲苯中加入少量酸性高锰酸钾溶液,振荡后褪色,正确的解释是由于侧链与苯环的相互影响,使侧链和苯环均易被氧化 | |
| B. | 等质量的乙烷、乙烯、乙炔在氧气中完全燃烧,乙烷消耗的氧气最多 | |
| C. | 间二溴苯仅有一种空间结构可证明苯分子中不存在单双键交替的结构 | |
| D. | 可向溴乙烷中加入硝酸银溶液检验溴元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com