
| 选项 | 含杂质的物质 | 试剂 | 除杂方法 |
| A | C2H4(SO2) | NaOH溶液 | 洗气 |
| B | C6H6(Br2) | Fe粉 | 蒸馏 |
| C | C6H5NO2(HNO3) | NaOH溶液 | 分液 |
| D | C2H6(C2H4) | 酸性KMnO4溶液 | 洗气 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.二氧化硫与NaOH溶液反应,而乙烯不能;
B.溴、苯在Fe作催化剂条件下反应;
C.硝酸与NaOH溶液反应,而硝基苯不能;
D.乙烯被氧化生成二氧化碳气体.
解答 解:A.二氧化硫与NaOH溶液反应,而乙烯不能,则利用洗气法可除杂,故A正确;
B.溴、苯在Fe作催化剂条件下反应,不能除杂,应加NaOH溶液分液来除杂,故B错误;
C.硝酸与NaOH溶液反应,而硝基苯不能,则加NaOH溶液分液可除杂,故C正确;
D.乙烯被氧化生成二氧化碳气体引入新杂质,应用溴水除杂,故D错误;
故选BD.
点评 本题考查混合物分离提纯方法的选择和应用,为高频考点,把握物质的性质及性质的差异为解答的关键,侧重混合物分离方法及除杂的考查,注意除杂的原则,题目难度不大.


科目:高中化学 来源: 题型:解答题
| 金属离子 | 开始沉淀的pH | 沉淀完全的pH |
| Fe3+ | 1.1 | 3.2 |
| Zn2+ | 5.5 | 8.0 |
| Cu2+ | 5.2 | 6.7 |
| Fe2+ | 5.8 | 8.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 蒸馏常用于分离提纯液态有机混合物 | |
| B. | 燃烧法是确定有机物成分的有效方法之一 | |
| C. | 红外光谱通常用于分析有机物的相对分子质量 | |
| D. | 核磁共振氢谱的研究有助于确定有机物分子中氢原子的类型和数目比 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
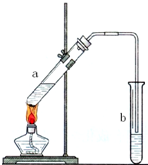 可用图示装置制取少量乙酸乙酯.已知乙酸乙酯的沸点低于乙醇.请填空:
可用图示装置制取少量乙酸乙酯.已知乙酸乙酯的沸点低于乙醇.请填空:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素编号 | 元素性质与原子(或分子)结构 | |
| T | 最外层电子数是次外层电子数的3倍 | |
| X | 常温下单质为双原子分子,分子中含有3对共用电子对 | |
| Y | M层比K层少1个电子 | |
| Z | 第三周期元素的简单离子中半径最小 | |
| W | W带两个负电荷的阴离子与Ar具有相同电子层结构 | |
 .
.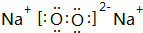 .
.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 实 验 | 现 象 | 结论 | |
| A | 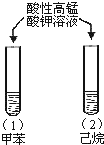 | 试管(1)中紫色褪去, 试管(2)中紫色未褪 | 苯环使甲基的活性增强 |
| B | 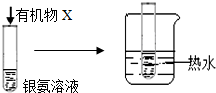 | 试管内壁有 银镜生成 | 有机物X中一定含有醛基 |
| C | 向淀粉溶液中加入稀硫酸,水浴加热,一段时间后,再加入新制的氢氧化铜悬浊液并加热 | 未见砖红色沉淀 | 淀粉未水解 |
| D | 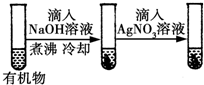 | 最后一只试管中有浅黄色沉淀 | 有机物中含有溴原子 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
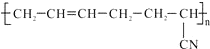 ,其具有优良的耐油、耐高温性能,合成丁腈橡胶的原料是( )
,其具有优良的耐油、耐高温性能,合成丁腈橡胶的原料是( )| A. | ①③⑤ | B. | ①③ | C. | ①④⑥ | D. | ④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
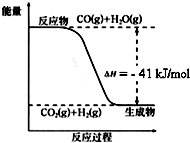 已知工业制氢气的反应为CO(g)+H2O(g)?CO2(g)+H2(g),反应过程中能量变化如图所示.在500℃时的平衡常数 K=9.若在2L的密闭容器中CO和水蒸气的起始浓度都是0.1mol/L,10min时达到平衡状态.
已知工业制氢气的反应为CO(g)+H2O(g)?CO2(g)+H2(g),反应过程中能量变化如图所示.在500℃时的平衡常数 K=9.若在2L的密闭容器中CO和水蒸气的起始浓度都是0.1mol/L,10min时达到平衡状态.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com