
| 时间(min) | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 阴极产生气体 的体积(cm3) | 6 | 12 | 20 | 29 | 39 | 49 | 59 | 69 | 79 | 89 |
| 阳极产生气体 的体积(cm3) | 2 | 4 | 7 | 11 | 16 | 21 | 26 | 31 | 36 | 41 |
 =64 g/mol。
=64 g/mol。

科目:高中化学 来源:不详 题型:单选题
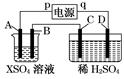
| | a电极 | b电极 | x溶液 | 实 验 现 象 |
| A | 石墨 | 石墨 | CuCl2 | a极质量增加,b极放出无色气体 |
| B | Fe | 石墨 | KNO3 | a极质量增加,b极放出无色气体 |
| C | Fe | Cu | CuSO4 | a极质量增加,b极质量减少 |
| D | 石墨 | 石墨 | HCl | a极放出无色气体,b极放出无色气体 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
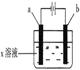
| A.Cu2+物质的量浓度 | B.C棒的质量 |
| C.Fe棒的质量 | D.Cl-物质的量浓度 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.1.12LH2 | B.1.12LO2 | C.2.24LH2 | D.2.24LO2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

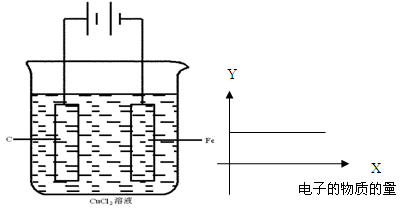
| A.a 为电源的正极 |
| B.通电一段时间后,石墨电极附近溶液先变红 |
| C.Fe电极的电极反应是4OH-- 4e-=2H2O+O2↑ |
D.电解饱和食盐水的总反应是: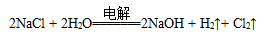 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
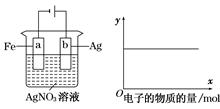
| A.①③ | B.③④ | C.①②④ | D.①②⑤ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
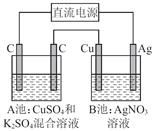
| A.0.05 mol/L | B.0.035 mol/L | C.0.025 mol/L | D.0.020 mol/L |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
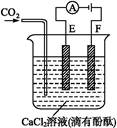
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
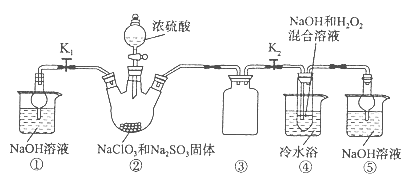
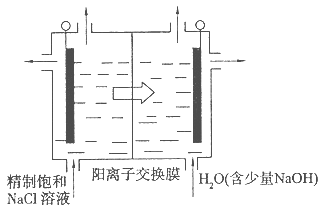
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com