
(7分)如图所示装置:
①若烧杯中溶液为稀硫酸,
电极反应式为:正极 ;
负极 。
②若烧杯中溶液为氢氧化钠溶液,则负极为 ,
总反应方程为 。
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:


| 32m2 |
| 233m1 |
| 32m2 |
| 233m1 |

查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
 某同学利用下列装置实现铜与浓硝酸、稀硝酸反应,过程如图所示:
某同学利用下列装置实现铜与浓硝酸、稀硝酸反应,过程如图所示:| 实验编号 | 水温/℃ | 液面上升高度 | ||
| 1 | 25 | 超过试管的
| ||
| 2 | 50 | 不足试管的
| ||
| 3 | 0 | 液面上升超过实验1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
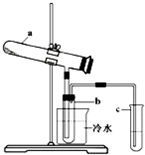 生产硫酸最古老的方法是以绿矾为原料,在蒸馏釜中煅烧.反应的化学方程式为:
生产硫酸最古老的方法是以绿矾为原料,在蒸馏釜中煅烧.反应的化学方程式为:
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
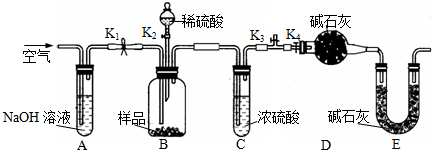
| 31n |
| 11m |
| 31n |
| 11m |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||


查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com