
25℃时,在氢氧化镁悬浊液中存在沉淀溶解平衡:Mg(OH)2(s) ![]() Mg2+(aq) +2OH-(aq) ,已知25℃时Ksp[Mg(OH)2]=1.8×10-11,Ksp[Cu(OH)2]=2.2×10-20。下列说法错误的是( )
Mg2+(aq) +2OH-(aq) ,已知25℃时Ksp[Mg(OH)2]=1.8×10-11,Ksp[Cu(OH)2]=2.2×10-20。下列说法错误的是( )
A.若向Mg(OH)2浊液中加入少量NH4Cl(s),c(Mg2+)会增大
B.若向Mg(OH)2浊液中滴加CuSO4溶液,沉淀将由白色逐渐变为蓝色
C.若向Mg(OH)2浊液中加入适量蒸馏水,Ksp保持不变,故上述平衡不发生移动
D.若向Mg(OH)2浊液中加入少量Na2CO3(s),固体质量将增大
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源:2010年浙江省温州二中高二第二学期期中考试化学试题 题型:实验题
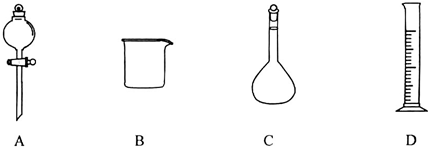
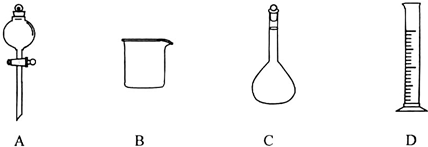
Ⅰ.下图为常见仪器的部分结构(有的仪器被放大)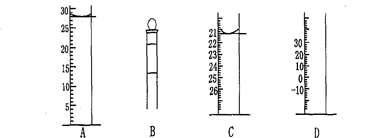
图A中液面所示溶液的体积为 mL,用上述四种仪器中的某种测量一液体的体积,平视时读数为n mL,仰视时读数为m mL,若m>n,则所使用的仪器是 (填字母标号)。
Ⅱ.某学生用标准0.25 mol·L—1 NaOH溶液滴定硫酸的实验操作如下:
| A.用酸式滴定管取稀H2SO4 25.00 mL,注入锥形瓶中,加入指示剂。 | |
| B.用待测定的溶液润洗酸式滴定管。 | C.用蒸馏水洗干净滴定管。 |
| D.取下碱式滴定管用标准的NaOH溶液润洗后,将标准液注入碱式滴定管刻度“0”以上2~3 cm处,再把碱式滴定管固定好,调节液面至刻度“0”或“0”刻度以下。 |
 Mg2+ +2OH-
Mg2+ +2OH-查看答案和解析>>
科目:高中化学 来源:2010年浙江省高二第二学期期中考试化学试题 题型:实验题
Ⅰ.下图为常见仪器的部分结构(有的仪器被放大)

图A中液面所示溶液的体积为 mL,用上述四种仪器中的某种测量一液体的体积,平视时读数为n mL,仰视时读数为m mL,若m>n,则所使用的仪器是 (填字母标号)。
Ⅱ.某学生用标准0.25 mol·L—1 NaOH溶液滴定硫酸的实验操作如下:
A.用酸式滴定管取稀H2SO4 25.00 mL,注入锥形瓶中,加入指示剂。
B.用待测定的溶液润洗酸式滴定管。 C.用蒸馏水洗干净滴定管。
D.取下碱式滴定管用标准的NaOH溶液润洗后,将标准液注入碱式滴定管刻度“0”以上2~3 cm处,再把碱式滴定管固定好,调节液面至刻度“0”或“0”刻度以下。
E.检查滴定管是否漏水。 F.另取锥形瓶,再重复操作一次。
G.把锥形瓶放在滴定管下面,瓶下垫一张白纸,边滴边摇动锥形瓶直至滴定终点,记下滴定管液面所在刻度。
①滴定操作的正确顺序是(用序号填): 。
②该滴定操作中应选用的指示剂是: 。
③在G操作中如何确定终? 。
④碱式滴定管用蒸馏水润洗后,未用标准液润洗导致滴定结果(填“偏小”、“偏大”或“恰好合适”) ,原因是 。
⑤假设操作均正确,标准液消耗了22.18mL,计算待测硫酸溶液的物质的量浓度(计算结果精确到小数点后二位) mol·L—1
Ⅲ.已知常温时醋酸的电离常数为1.8×10-5,一水合氨的电离常数为1.8×10-5。在少量Mg(OH)2悬浊液中,滴加适量饱和NH4Cl溶液,固体溶解。对于固体的溶解。
甲同学认为在氢氧化镁悬浊液中存在下列平衡:
Mg(OH)2  Mg2+ +2OH-
Mg2+ +2OH-
加入NH4Cl溶液,由于NH4+水解产生H+中和了Mg(OH)2电离产生的OH-而使平衡右移导致Mg(OH)2 溶解。
而乙同学却认为NH4Cl电离产生的NH4+结合了OH-生成了弱电解质NH3·H2O,使c(OH-)减小,平衡右移而导致Mg(OH)2 溶解。设计方案评价甲乙两位同学的观点:
_____________________________________ ______________________________
_________________________________________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com